SỬ DỤNG PHƯƠNG PHÁP THĂNG BẢNG SỐ MOL ELECTRON
Nguyên tắc: Khi có nhiều chất oxi hóa hoặc chất khử trong hỗn hợp phản ứng (nhiều phản ứng hoặc phản ứng qua nhiều giai đoạn) thì tổng số mol electron mà các chất khử cho phải bằng tổng số mol elctron mà các chất oxi hóa nhận vào.

Ưu việt của phương pháp này là có thể giải nhanh nhiều bài toán khó mà không cần viết phương trình phản ứng.
Ví dụ 1: Hoà tan hết 6,3 gam hỗn hợp X gồm Al và kim loại M (tỉ lệ mol tương
ứng 2:3) vào 200 gam dung dịch HNO3 31,5%, kết thúc các phản ứng thu được dung dịch Y và 1,568 lít (đktc) hỗn hợp hai khí N2 và N2O có tổng khối lượng là 2,76 gam. Cho Y phản ứng với dung dịch NaOH đun nóng, không có khí thoát ra.
a) Xác định tên kim loại M.
b) Tính thể tích dung dịch NaOH 0,5M tối thiểu cần dùng để kết tủa hết các ion kim loại trong Y.
Giải
a) Gọi x, y lần lượt là số mol N2 và N2O.
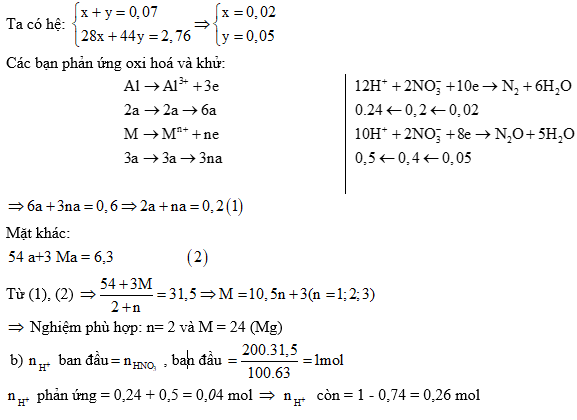
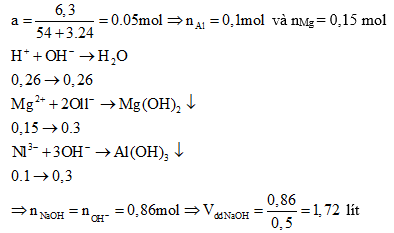
Ví dụ 2: Cho 6,3 gam hỗn hợp X gồm Mg và kin loại M (hoá trị không đổi) tác dụng với Cl2, sau một thời gian thu được 20,5 gam chất rắn Y. Yoà ta trong dung dịch HCl, sinh ra 2,24 lít H2 (đktc). Mặt khác, cho 0,1 mol M phản ứng với dung dịch HNO3 đặc, nóng dư thì lượng khí NO2 thoát ra vượt quá 5,04 lít (đktc).
a) Xác định tên kim loại M.
b) Cho 12,6 gam X trên tác dụng với dung dịch HNO3 loãng (dư), kết thúc phản ứng thu được 2,24 lít (đktc) hỗn hợp khí X gồm N2 và N2O có tỉ khối so với H2 là 18. Tính khối lượng muối thu được sau khi các phản ứng kết thúc.
Giải



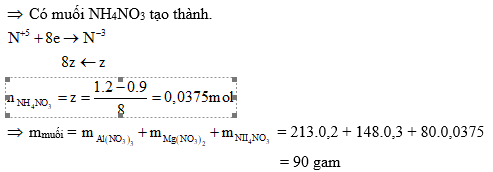
Ví dụ 3: Chia 29,6 gam hỗn hợp X gồm Fe và Cu thành hai phần bằng nhau. Phần 1 cho phản ứng với lượng dư dung dịch HCl, sinh ra 3,36 lít H2 (đktc). Cho phân 2 tác dụng với dung dịch HNO3 đặc, nóng (dư) thu được V lít khí NO2 (đktc) và dung dịch Y.
a) Tính giá trị của V
b) Cho Y phản ứng với lượng dư dung dịch NH3. Tính khối lượng kết tủa thu được sau khi các phản ứng kết thúc.
Giải


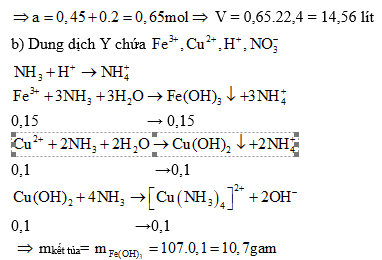
Ví dụ 4: Chia 23,8 gam hỗn hợp X gồm Al, Mg và Fe thành hai phần bằng nhau.
Phần 1 cho phản với dung dịch NaOH dư, sinh ra 3,36 lít H2 (đktc) và còn lại chất rắn Y không tan. Cho toàn bộ Y phản ứng với dung dịch H2SO4 đặc, nóng (dư) thu được 6,72 lít SO2(sản phẩm khử duy nhất, đktc). Cho phần 2 tác dụng với 240 gam dung dịch HNO3 31,5%, kết thúc các phản ứng thu được dung dịch A và 1,568 lít (đktc) hỗn hợp hai khí N2 và N2O có tổng khối lượng 2,76 gam.
a) Tính khối lượng các muối tạo thành trong dung dịch A.
b) Dung dịch A hoà tan tối đa bao nhiêu gam Cu. Biết sản phẩm khử của

c) Tính thể tích dung dịch NaOH 1M tối thiểu cần dùng để phản ứng hết với dung dịch A.
Giải
a) • Phần 1: Mg và Fe không phản ứng
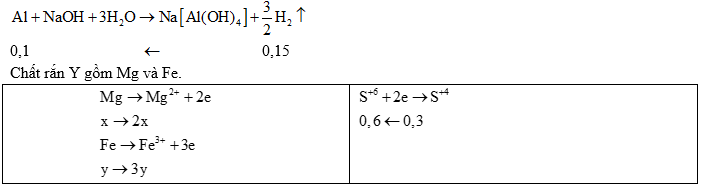




Ví dụ 5: Cho 8,7 gam hỗn hợp X gồm kim loại M (thuộc nhóm IIA) và Al tan hết vào 160 gam dung dịch HNO3 31,5%, sau khi kết thúc các phản ứng thu được dung dịch Y và 1,232 lít (đktc) hỗn hợp hai khí N2 và N2O có tỉ khối so với H2 là 17,636. Dung dịch Y phản ứng với dung dịch NaOH đun nóng không có khí thoát ra. Mặt khác, cho 4,2 gam kim loại M phản ứng với dung dịch HCl dư thì lượng khí thoát ra vượt quá 2,24 lít (đktc).
a) Xác định tên kim loại M
b) Cho 17,4 gam X trên vào nước dư, tính thể tích khí thoát ra (đktc).
Giải

b) Trong 17,4 gam X có chứa 0,38 mol Ca và 0,078 mol Al. Ta có:
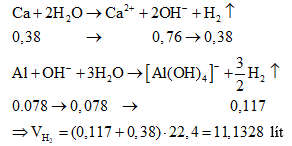
Ví dụ 6: Cho hỗn hợp gồm a mol FeS2 và b mol Cu2S phản ứng hết với lượng vừa đủ dung dịch HNO3, thu được dung dịch X chỉ chứa 2 muối sunfat và 10,08 lít khí N2O (sản phẩm khử duy nhất, ở đktc). Tính giá trị của a và b.
Giải

Ý kiến bạn đọc
Bạn cần đăng nhập với tư cách là Thành viên chính thức để có thể bình luận
Những tin mới hơn
Những tin cũ hơn
global video
-
-
 Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
-
 Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
-
 Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Thăm dò ý kiến
Tin xem nhiều
-
 Bài tập về thấu kính hội tụ
Bài tập về thấu kính hội tụ
-
 DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
-
 ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
-
 ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
-
 Bài tập về thấu kính phân kỳ
Bài tập về thấu kính phân kỳ
-
 Dạng bài tập về Đoạn mạch nối tiếp
Dạng bài tập về Đoạn mạch nối tiếp
-
 Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
-
 Dạng bài tập đoạn mạch song song
Dạng bài tập đoạn mạch song song
-
 CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
-
 TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
Thống kê
- Đang truy cập87
- Hôm nay22,432
- Tháng hiện tại742,346
- Tổng lượt truy cập18,830,530
Tài liệu mới
- chuyên đề Phương trình... - 18/04/2022
- Phương trình chứa ấn ở... - 28/02/2020
- Các dạng bài tập phương... - 28/02/2020
- Giáo án dạy thêm toán 6 - 27/02/2020
- Chuyên đề bồi dưỡng học... - 27/02/2020
