AMIN
I.KHÁI NIỆM 1.Định nghĩaAmin là dẫn xuất thế H của NH3, bằng các gốc hiđrocacbon béo hay thơm

Amin loại béo: gốc hiđrocacbon là gốc ankyl hay xicloankyl
CH3-CH2CH2-NH2
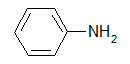
Amin thơm, gốc hyđrocacbon là nhân thơm:
2.Bậc amin:
Amin bậc 1, có nhóm chức amin -NH2 đính với 1 gốc hiđrocacbon
Amin bậc 2, có nhóm chức amin –NH đính với hai gốc hiđrocacbon
Amin bậc 3, N đính với 3 gốc hiđrocacbon
RNH2 (CH3)2CNH2 R2NH CH3CH2NHCH3 R3N (CH3)3N
amin bậc nhất amin bậc hai amin bậc ba
II.DANH PHÁP
Amin thường được gọi theo tên thông thường hơn là IUPAC

III.PHƯƠNG PHÁP TỔNG HỢP
1. Ankyl hóa trực tiếp amoniac hay amin
NH3 tác dụng với RX tạo thành muối:
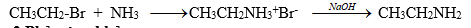
2.Phản ứng khử
a, Khử hợp chất nitro
Nhóm nitro bị khử thành amin bậc nhất. Phản ứng chủ yếu dùng để điều chế amin thơm. Tác nhân khử có thể là hiđro hóa xúc tác hay tác nhân khử hóa học trong dung dịch.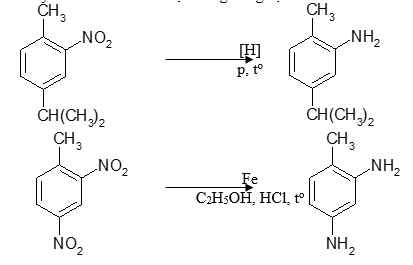
b,Khử hợp chất nitrin
Nitrin bị khử bằng hiđro trên xúc tác hoặc bằng LiAlH4 trong dung dịch để tạo thành amin bậc nhất:
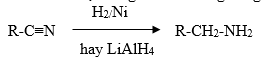
IV.CẤU TRÚC
Amin là sản phẩm thế của NH3, nên nói chung có cấu trúc giống cấu trúc của NH3:
NH3 R-NH2 R-NH-R R-N-R
|

 R
R
V.TÍNH CHẤT HÓA HỌC
1. Tính bazơ
Amin là bazơ Lewis do amin có cặp electron n không liên kết ở N tương tự như ancol, ete. Khi xét một amin có tính bazơ, cần so sánh tính ổn định của amin so với muối amoni. Nếu ion amoni ổn định hơn amin thì amin đó có tính bazơ. Khi so sánh tính bazơ của amin béo, cần chú ý hai nhân tố: nhân tố phân cực và nhân tố solvat hóa.
Nếu xét theo nhân tố phân cực, khi tăng gốc R sẽ làm tăng mật độ electron ở N, vừa làm tăng khả năng kết hợp proton, vừa làm tăng tính ổn định của ion amoni. Do đó tính bazơ giảm theo thứ tự:
R3N > R2NH > RNH2
Nếu xét theo nhân tố solvat hóa của ion amoni, số lượng proton ở ion amoni càng nhiều thì khả năng solvat hóa của ion đó càng lớn, do đó, tính bazơ thay đổi theo thứ tự:
RNH3+ > R2NH+2 > R3NH+
Tổng hợp cả hai nhân tố trên, sự thay đổi tính bazơ của các amin có bậc khác nhau như sau:
RNH2 < R2NH > R3N
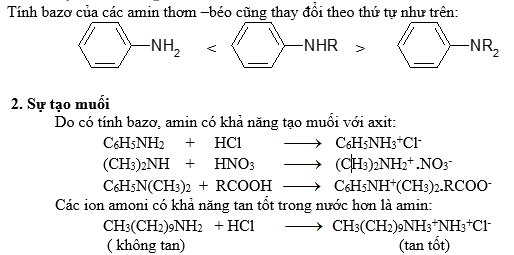
3.Phản ứng của hiđrô của N-H
3.1. Phản ứng ankyl hóa
Hiđro đính với N có thể bị thế bởi gốc hiđrocacbon khi amin tương tác với halogenua ankyl bậc 1, 2, 3 hay thơm. Nếu ankyl hóa hoàn toàn thì thu được muối amoni bậc 4:
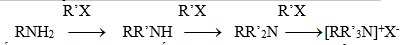
Muối amoni bậc 4 là hợp chất inoic, có nhiệt độ nóng chảy cao và dễ tan trong nước…
Chú ý: Các dẫn xuát thơn chỉ tham gia phản ứng khi có nhóm hút electron ở vị trí ortho và pa ra, thí dụ như 2, 4-(NO2)C6H3F
3.2. Phản ứng axyl hóa
Amin bậc nhất và amin bậc hai phản ứng với halogenua axit hay anhiđrit axit tạo thành amit:
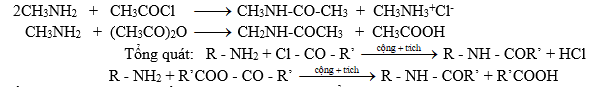
Nếu dùng clorua axit thì cần 1 lượng tương đương để trung hòa axit clohiđric tạo thành.
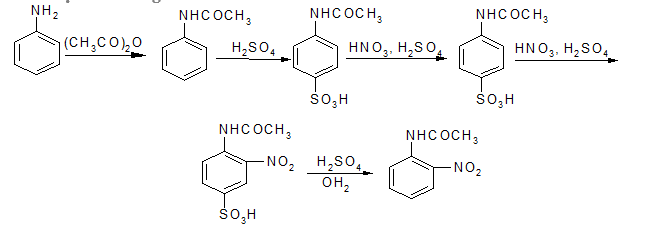
Ứng dụng: Để bảo vệ nhóm -NH2 trong tổng hợp hữu cơ
Nhờ phản ứng axetyl hoá (dùng axetyl clorua hoặc anhiđrit axetic người ta bảo vệ nhóm amino trong tổng hợp hữu cơ ).
Để bảo vệ nhóm amino của aminoaxit và peptit trong qua trình tổng hợp peptit, không dùng phản ứng axetyl hoá được, vì khi muốn giải phóng nhóm -NH2 ra khỏi -NHCOCH3 phải thuỷ phân, do đó làm đứt luôn cả liên kết peptit - CO - NH -. Tốt hơn hết nên dùng C6H5CH2OCOCl (benzyl oxicacbonyl clorua) vì khi cần giải phóng nhóm - NH2 có thể dùng phản ứng khử bằng H2/Pd (không ảnh hưởng tới liên kết peptit). Thí dụ tổng hợp đipeptit Ala-Gly theo sơ đồ:
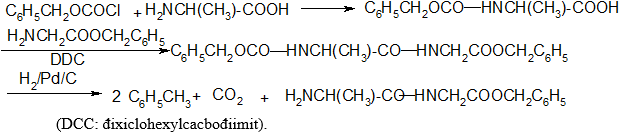
3.3. Phản ứng với axit nitrơ:
Axit nitrơ HONO gần như không tác dụng với amin bậc 3, trừ phản ứng nitroso hoá nhân thơm.
Axit nitrơ tác dụng với amin bậc hai sinh ra nitrosoamin(N - nitrosoamin) có màu vàng, nhờ vậy có thể phân biệt amin bậc hai với amin các bậc khá. Thí dụ:
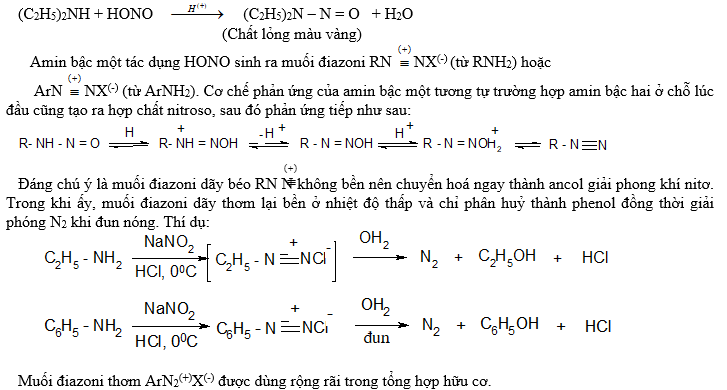
3.4. Phản ứng thế ở nhân thơm:
Các nhóm -NH2, -NHR và - NR2 (R = ankyl) đều hoạt hoá nhân thơm và định hướng ortho - para.
a, Halogen hoá
Nước brom dễ dàng phản ứng với anilin cho 2, 4, 6 - tribromoannilin (kết tủa trắng), với p - toluidin p - CH3C6H4NH2 cho 2,6 - đibrom - 4 - metylanilin.
Brom lỏng tác dụng vào vị trí para của N - axetylanilin (hay axetanilit) C6H5NH - COCH3; thuỷ phân sản phẩm sinh ra sẽ được p - bromanilin.
Iot trong hỗn hợp với NaHCO3 (để trung hoà HI sinh ra trong phản ứng) tác dụng với anilin cho ta p - Iotanilin.
b, Nitro hoá
Không thể trực tiếp nitro hoá anilin bằng HNO3, vì khi ấy amin bị proton hoá trở thành muối amoni; nhóm - sinh ra sẽ phản hoạt hoá rất mạnh và định hướng thế vào vị trí meta, muốn mononitro hoá anilin phải bảo vệ nhóm - NH2 rồi mới nitro hoá, sau đó giải phóng - NH2.
sinh ra sẽ phản hoạt hoá rất mạnh và định hướng thế vào vị trí meta, muốn mononitro hoá anilin phải bảo vệ nhóm - NH2 rồi mới nitro hoá, sau đó giải phóng - NH2.
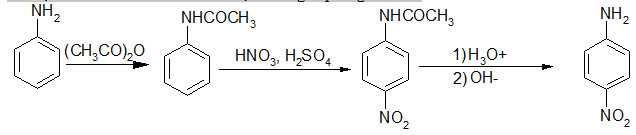
Nếu muốn đưa nhóm nitrơ vào vị trí ortho phải “khoá” vị trí para rồi mới nitro hoá:
CH3-CH2CH2-NH2
Amin thơm, gốc hyđrocacbon là nhân thơm:

2.Bậc amin:
Amin bậc 1, có nhóm chức amin -NH2 đính với 1 gốc hiđrocacbon
Amin bậc 2, có nhóm chức amin –NH đính với hai gốc hiđrocacbon
Amin bậc 3, N đính với 3 gốc hiđrocacbon
RNH2 (CH3)2CNH2 R2NH CH3CH2NHCH3 R3N (CH3)3N
amin bậc nhất amin bậc hai amin bậc ba
II.DANH PHÁP
Amin thường được gọi theo tên thông thường hơn là IUPAC
| Tên gốc hiđrocacbon+amin (viết liền 1 chữ) |
X-amino + tên hiđrocacbon |

III.PHƯƠNG PHÁP TỔNG HỢP
1. Ankyl hóa trực tiếp amoniac hay amin
NH3 tác dụng với RX tạo thành muối:
2.Phản ứng khử
a, Khử hợp chất nitro
Nhóm nitro bị khử thành amin bậc nhất. Phản ứng chủ yếu dùng để điều chế amin thơm. Tác nhân khử có thể là hiđro hóa xúc tác hay tác nhân khử hóa học trong dung dịch.

b,Khử hợp chất nitrin
Nitrin bị khử bằng hiđro trên xúc tác hoặc bằng LiAlH4 trong dung dịch để tạo thành amin bậc nhất:
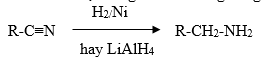
IV.CẤU TRÚC
Amin là sản phẩm thế của NH3, nên nói chung có cấu trúc giống cấu trúc của NH3:
NH3 R-NH2 R-NH-R R-N-R
|

 R
R V.TÍNH CHẤT HÓA HỌC
1. Tính bazơ
Amin là bazơ Lewis do amin có cặp electron n không liên kết ở N tương tự như ancol, ete. Khi xét một amin có tính bazơ, cần so sánh tính ổn định của amin so với muối amoni. Nếu ion amoni ổn định hơn amin thì amin đó có tính bazơ. Khi so sánh tính bazơ của amin béo, cần chú ý hai nhân tố: nhân tố phân cực và nhân tố solvat hóa.
Nếu xét theo nhân tố phân cực, khi tăng gốc R sẽ làm tăng mật độ electron ở N, vừa làm tăng khả năng kết hợp proton, vừa làm tăng tính ổn định của ion amoni. Do đó tính bazơ giảm theo thứ tự:
R3N > R2NH > RNH2
Nếu xét theo nhân tố solvat hóa của ion amoni, số lượng proton ở ion amoni càng nhiều thì khả năng solvat hóa của ion đó càng lớn, do đó, tính bazơ thay đổi theo thứ tự:
RNH3+ > R2NH+2 > R3NH+
Tổng hợp cả hai nhân tố trên, sự thay đổi tính bazơ của các amin có bậc khác nhau như sau:
RNH2 < R2NH > R3N

3.Phản ứng của hiđrô của N-H
3.1. Phản ứng ankyl hóa
Hiđro đính với N có thể bị thế bởi gốc hiđrocacbon khi amin tương tác với halogenua ankyl bậc 1, 2, 3 hay thơm. Nếu ankyl hóa hoàn toàn thì thu được muối amoni bậc 4:
Muối amoni bậc 4 là hợp chất inoic, có nhiệt độ nóng chảy cao và dễ tan trong nước…
Chú ý: Các dẫn xuát thơn chỉ tham gia phản ứng khi có nhóm hút electron ở vị trí ortho và pa ra, thí dụ như 2, 4-(NO2)C6H3F
3.2. Phản ứng axyl hóa
Amin bậc nhất và amin bậc hai phản ứng với halogenua axit hay anhiđrit axit tạo thành amit:
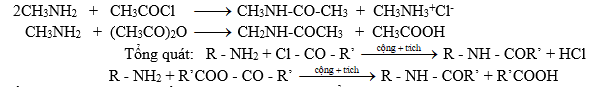
Nếu dùng clorua axit thì cần 1 lượng tương đương để trung hòa axit clohiđric tạo thành.
Ứng dụng: Để bảo vệ nhóm -NH2 trong tổng hợp hữu cơ
Nhờ phản ứng axetyl hoá (dùng axetyl clorua hoặc anhiđrit axetic người ta bảo vệ nhóm amino trong tổng hợp hữu cơ ).
Để bảo vệ nhóm amino của aminoaxit và peptit trong qua trình tổng hợp peptit, không dùng phản ứng axetyl hoá được, vì khi muốn giải phóng nhóm -NH2 ra khỏi -NHCOCH3 phải thuỷ phân, do đó làm đứt luôn cả liên kết peptit - CO - NH -. Tốt hơn hết nên dùng C6H5CH2OCOCl (benzyl oxicacbonyl clorua) vì khi cần giải phóng nhóm - NH2 có thể dùng phản ứng khử bằng H2/Pd (không ảnh hưởng tới liên kết peptit). Thí dụ tổng hợp đipeptit Ala-Gly theo sơ đồ:
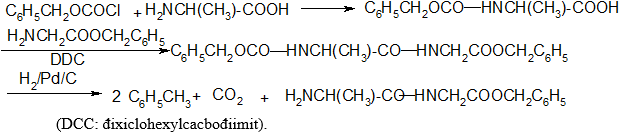
3.3. Phản ứng với axit nitrơ:
Axit nitrơ HONO gần như không tác dụng với amin bậc 3, trừ phản ứng nitroso hoá nhân thơm.
Axit nitrơ tác dụng với amin bậc hai sinh ra nitrosoamin(N - nitrosoamin) có màu vàng, nhờ vậy có thể phân biệt amin bậc hai với amin các bậc khá. Thí dụ:

3.4. Phản ứng thế ở nhân thơm:
Các nhóm -NH2, -NHR và - NR2 (R = ankyl) đều hoạt hoá nhân thơm và định hướng ortho - para.
a, Halogen hoá
Nước brom dễ dàng phản ứng với anilin cho 2, 4, 6 - tribromoannilin (kết tủa trắng), với p - toluidin p - CH3C6H4NH2 cho 2,6 - đibrom - 4 - metylanilin.
Brom lỏng tác dụng vào vị trí para của N - axetylanilin (hay axetanilit) C6H5NH - COCH3; thuỷ phân sản phẩm sinh ra sẽ được p - bromanilin.
Iot trong hỗn hợp với NaHCO3 (để trung hoà HI sinh ra trong phản ứng) tác dụng với anilin cho ta p - Iotanilin.
b, Nitro hoá
Không thể trực tiếp nitro hoá anilin bằng HNO3, vì khi ấy amin bị proton hoá trở thành muối amoni; nhóm -
 sinh ra sẽ phản hoạt hoá rất mạnh và định hướng thế vào vị trí meta, muốn mononitro hoá anilin phải bảo vệ nhóm - NH2 rồi mới nitro hoá, sau đó giải phóng - NH2.
sinh ra sẽ phản hoạt hoá rất mạnh và định hướng thế vào vị trí meta, muốn mononitro hoá anilin phải bảo vệ nhóm - NH2 rồi mới nitro hoá, sau đó giải phóng - NH2.
Nếu muốn đưa nhóm nitrơ vào vị trí ortho phải “khoá” vị trí para rồi mới nitro hoá:

Ý kiến bạn đọc
Bạn cần đăng nhập với tư cách là Thành viên chính thức để có thể bình luận
Những tin mới hơn
global video
-
-
 Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
-
 Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
-
 Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Thăm dò ý kiến
Tin xem nhiều
-
 Bài tập về thấu kính hội tụ
Bài tập về thấu kính hội tụ
-
 DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
-
 ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
-
 ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
-
 Bài tập về thấu kính phân kỳ
Bài tập về thấu kính phân kỳ
-
 Dạng bài tập về Đoạn mạch nối tiếp
Dạng bài tập về Đoạn mạch nối tiếp
-
 Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
-
 Dạng bài tập đoạn mạch song song
Dạng bài tập đoạn mạch song song
-
 CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
-
 TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
Thống kê
- Đang truy cập146
- Hôm nay29,389
- Tháng hiện tại131,913
- Tổng lượt truy cập18,990,642
Tài liệu mới
- chuyên đề Phương trình... - 18/04/2022
- Phương trình chứa ấn ở... - 28/02/2020
- Các dạng bài tập phương... - 28/02/2020
- Giáo án dạy thêm toán 6 - 27/02/2020
- Chuyên đề bồi dưỡng học... - 27/02/2020
