Cacbon và silic
Cacbon - silic thuộc nhóm IVA của bảng hệ thống tuần hoàn. Trong nhóm có các nguyên tố cacbon C, silic Si, gemani Ge, thiếc Sn và chì Pb. Nguyên tử của các nguyên tố này có 4 electron lớp ngoài cùng, có cấu hình ns2np2. Theo chiều tăng của điện tích hạt nhân, tính chất của các nguyên tố biến đổi như sau: cacbon C và silic Si là các phi kim rõ rệt, thiếc Sn và chì Pb là các kim loại, gemani Ge là nguyên tố trung gian.
Ta chỉ tìm hiểu hai nguyên tố có nhiều ứng dụng nhất là cacbon C, silic Si.
Ta chỉ tìm hiểu hai nguyên tố có nhiều ứng dụng nhất là cacbon C, silic Si.

I. Đơn chất cacbon:
1. Tính chất vật lí:
Cacbon là chất rắn, tồn tại ở nhiều dạng thù hình:
- Kim cương: tinh thể trong suốt, là vật liệu cứng nhất trong tự nhiên, dẫn nhiệt kém, không dẫn điện.
- Than chì: màu xám, có ánh kim, mềm, dẫn điện tốt thường được dùng làm điện cực.
- Than vô định hình: than đá, than gỗ, mồ hóng.
2. Tính chất hóa học:
ở điều kiện thường, cacbon là phi kim hoạt động hoá học kém. Nhưng khi đun nóng, đơn chất cacbon khá hoạt động.
a. Thể hiện tính khử đối với các chất oxi hoá, chẳng hạn:
- Cháy với oxi: ở nhiệt độ cao (trên 9000C) thì sản phẩm tạo thành chủ yếu là CO. ở nhiệt độ thấp hơn (dưới 5000C) thì sản phẩm tạo thành chủ yếu là CO2:
C + O2 ® CO2
2C + O2 ® 2 CO
Ngoài ra thể còn có phản ứng: C + CO2 ® 2 CO
- Phản ứng với chất oxi hoá khác:

II. Hợp chất:
1. Cacbon oxit (CO): là khí độc, thể hiện tính khử mạnh
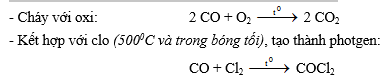
Nếu được chiếu sáng, phản ứng có thể xảy ra ở nhiệt độ thường.
(Photgen là chất rất độc, trong chiến tranh thế giới thứ nhất đã được dùng để làm bom hơi ngạt. Ngày nay, người ta dùng nó trong các phản ứng tổng hợp hữu cơ).
- Khử oxit kim loại ở nhiệt độ cao:

3. Muối cacbonat: Axit cacbonic tạo ra hai muối là cacbonat và hiđrocacbonat.
- Muối cacbonat: chỉ có các muối của kim loại kiềm và amoni là tan tốt trong nước (riêng Li2CO3 tan vừa phải trong nước nguội và tan ít hơn trong nước nóng). Dung dịch của các muối này trong nước có xảy ra quá trình thủy phân, nên môi trường có tính kiềm (đối với muối amoni cacbonat cũng vậy).
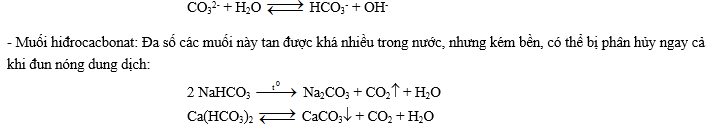
III. Trạng thái thiên nhiên:
Cacbon tồn tại ở cả dạng đơn chất và hợp chất trong tự nhiên.
Đơn chất như: than đá, kim cương, than chì.
Hợp chất như: CaCO3 (đá vôi, đá phấn, đá hoa), MgCO3 (manhêzit), CaCO3.MgCO3 (đôlômit), FeCO3 (xiđêrit), CuCO3.Cu(OH)2 (malakit).
Ngoài ra cacbon còn tồn tại một lượng lớn trong các hợp chất hữu cơ (dầu mỏ, khí đốt, ...)
IV. Silic và công nghiệp silicat
1. Silic là một trong những nguyên tố phổ biến nhất trong vỏ Trái đất (đứng hàng thứ hai sau nguyên tố oxi)
Silic có hai dạng thù hình, dạng vô định hình và dạng tinh thể. Dạng tinh thể có cấu trúc tương tự kim cương, giòn và cứng, có ánh kim dẫn điện và dẫn nhiệt kém.
Silic là nguyên tố ít hoạt động hoá học.
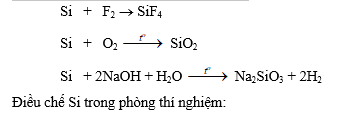
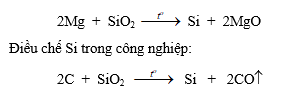
2. Hợp chất của silic
a. Silic đioxit (SiO2)
SiO2 là chất rắn không tan trong nước, khó nóng chảy (16100), có tên gọi là thạch anh. Cát trắng là những hạt thạch anh nhỏ.
SiO2 là oxit axit. ở nhiệt độ cao, SiO2 tác dụng với oxit bazơ, kiềm, cacbonat kim loại kiềm tạo ra silicat:
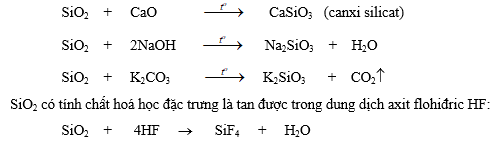
Vì vậy người ta dùng axit flohiđric để khắc hình trên thuỷ tinh.
SiO2 được dùng rộng rãi trong xây dựng, sản xuất thuỷ tinh, đá mài...
b. Axit silicic và muối silicat
Axit silicic có công thức hoá học là H2SiO3, là axit yếu, ít tan trong nước.
Điều chế axit silicic bằng cách cho axit clohiđric tác dụng với dung dịch silicat, được dung dịch H2SiO3 dưới dạng keo:
2HCl + Na2SiO3 ® H2SiO3 + 2NaCl
Muối của axit silicic có tên là silicat. Natri và kali silicat trông bề ngoài giống thuỷ tinh, nhưng tan được trong nước, vì vậy chúng có tên là thuỷ tinh tan. Dung dịch của chúng tan trong nước gọi là thuỷ tinh lỏng.
Thuỷ tinh tan dùng để chế tạo xi măng và bêtông chịu axit, dùng làm lớp bảo vệ gỗ không cháy, sản xuất silicagen. Silicagen là một polime vô cơ có công thức (SiO2)n là một chất chống ẩm rất tốt, dùng trong bảo quản phim ảnh, băng đĩa hình, thực phẩm cao cấp ...
3. Công nghiệp silicat
a. Sản xuất thủy tinh: kính, chai lọ, cốc, chén …
b. Sản xuất đồ gốm: gạch, ngói, chum, vại, bát đĩa...
c. Sản xuất xi măng
1. Có 1 lít dung dịch hỗn hợp Na2CO3 0,1 M và (NH4)2CO3 0,25 M. Cho 43 g hỗn hợp BaCl2 và CaCl2 vào dung dịch đó. Sau khi các phản ứng kết thúc thu được 39,7 g kết tủa A và dung dịch B.
1. Tính % khối lượng các chất có trong A.
2. Chia dung dịch B thành 2 phần bằng nhau:
a. Cho axit HCl vào một phần, cô cạn dung dịch và nung chất rắn còn lại tới khối lượng không đổi được chất rắn X. Tính % khối lượng các chất trong X.
b. Đun nóng phần thứ hai rồi thêm từ từ 270 ml dung dịchBa(OH)2 0,2 M vào. Hỏi tổng khối lượng của 2 dung dịch giảm tối đa bao nhiêu gam ? Giả sử nước bay hơi không đáng kể.
Cho C = 12; O = 16; Cl = 35,5 ; Ca = 40; Ba = 137.
Giải
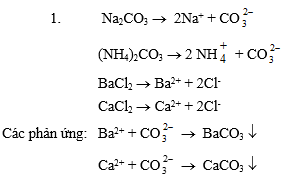
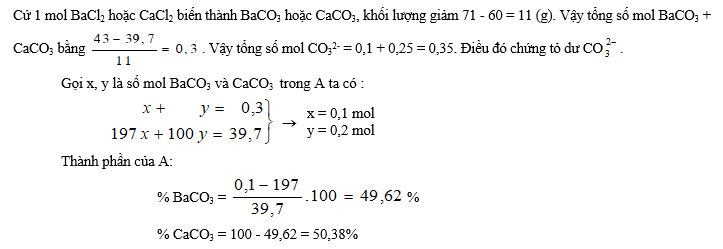
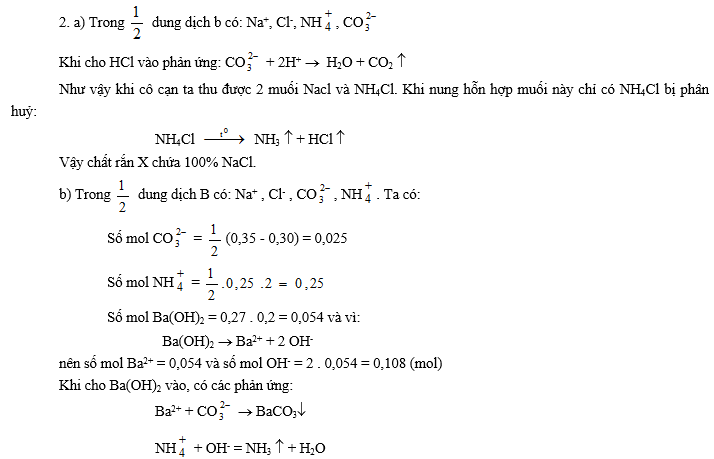
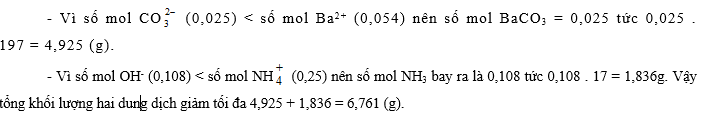
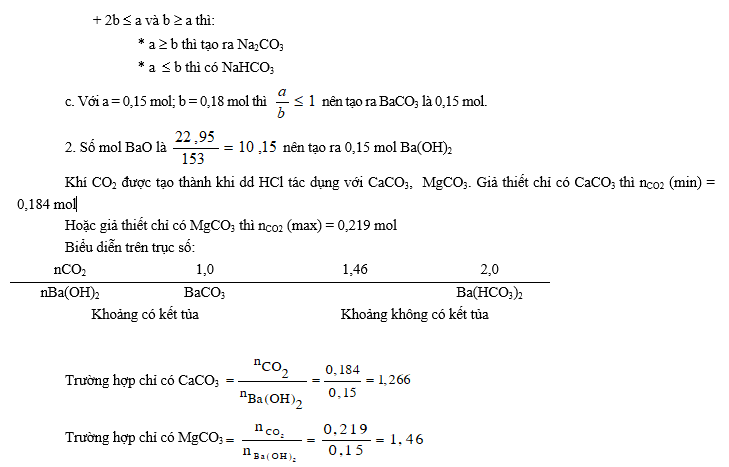
Bài 2. 1. Cho a mol CO2 tác dụng với b mol Ba(OH)2.
a. Hãy giải thích sự phụ thuộc giữa a và b theo các điều kiện sau:
b ≤ a ≤ 2b ; 2b ≤ a và b > a.
b. Khi thay Ba(OH)2 bằng NaOH thì các bất đẳng thức trên còn đúng hay không?
c. áp dụng a = 0,15 mol, b = 0,18 mol ứng với các điều kiện nào trong các điều kiện trên.
2. Hoà tan 22,95 g BaO vào nước được dung dịch A. Cho 18,4 g hỗn hợp CaCO3 và MgCO3 hoà tan hết trong dung dịch HCl thu được khí B. Nếu cho dung dịch A hấp thụ hết khí B thì có kết tủa tạo thành hay không ?
3. Nếu 14,2 g hỗn hợp hai muối trên trong đó có a% MgCO3 tác dụng với dung dịch A thì a có giá trị bằng bao nhiêu để cho lượng kết tủa có trong dung dịch là cao nhất, thấp nhất ?
Giải

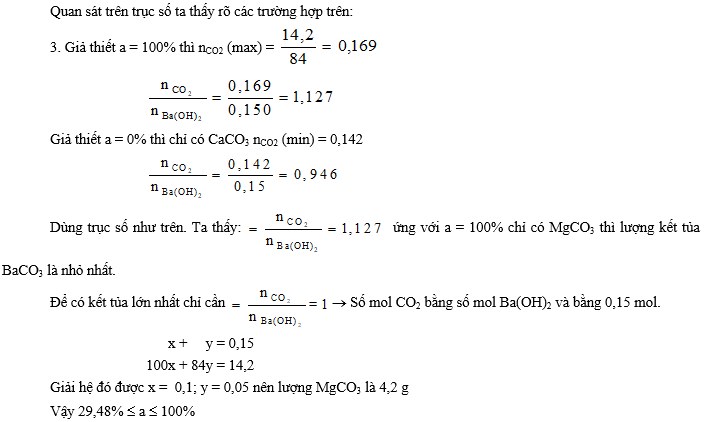
4. Hoà tan hoàn toàn 11,2 g CaO vào nước ta được dung dịch A.
1. Nếu cho khí CO2 sục qua dung dịch A và sau khi kết thúc thí nghiệm thấy có 2,5g kết tủa thì có bao nhiêu lít CO2 đã tham gia phản ứng ?
2. Nếu hoà tan hoàn toàn 28,1 g hỗn hợp MgCO3 và BaCO3 có thành phần không đổi trong đó chứa a% MgCO3 bằng dung dịch HCl và cho tất cả khí thoát ra hấp thụ hết vào dung dịch A thì thu được kết tủa D. Hỏi khi a có giá trị bao nhiêu thì lượng kết tủa D nhiều nhất và ít nhất.
Cho: C = 12 ; O = 16 ; Mg = 24 ; Ca = 40 ; Ba = 137.
Giải

Tóm lại: 0,14 ≤ nCO2 ≤ 0,33.
- Nếu nCO2 = 0,14 < nCa(OH)2, tức là không có phản ứng (3) và nCaCO3 = nCO2 = 0,14.
- Nếu nCO2 = 0,33 > nCa(OH)2, tức là xảy ra phản ứng (2) và (3) nên lượng kết tủa bằng: nCaCO3 = 0,2 - (0,33 – 0,2) = 0,07 (mol).
Vậy khi a = 100% thì lượng kết tủa bé nhất.
1. Tính chất vật lí:
Cacbon là chất rắn, tồn tại ở nhiều dạng thù hình:
- Kim cương: tinh thể trong suốt, là vật liệu cứng nhất trong tự nhiên, dẫn nhiệt kém, không dẫn điện.
- Than chì: màu xám, có ánh kim, mềm, dẫn điện tốt thường được dùng làm điện cực.
- Than vô định hình: than đá, than gỗ, mồ hóng.
2. Tính chất hóa học:
ở điều kiện thường, cacbon là phi kim hoạt động hoá học kém. Nhưng khi đun nóng, đơn chất cacbon khá hoạt động.
a. Thể hiện tính khử đối với các chất oxi hoá, chẳng hạn:
- Cháy với oxi: ở nhiệt độ cao (trên 9000C) thì sản phẩm tạo thành chủ yếu là CO. ở nhiệt độ thấp hơn (dưới 5000C) thì sản phẩm tạo thành chủ yếu là CO2:
C + O2 ® CO2
2C + O2 ® 2 CO
Ngoài ra thể còn có phản ứng: C + CO2 ® 2 CO
- Phản ứng với chất oxi hoá khác:

II. Hợp chất:
1. Cacbon oxit (CO): là khí độc, thể hiện tính khử mạnh
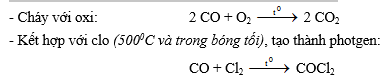
Nếu được chiếu sáng, phản ứng có thể xảy ra ở nhiệt độ thường.
(Photgen là chất rất độc, trong chiến tranh thế giới thứ nhất đã được dùng để làm bom hơi ngạt. Ngày nay, người ta dùng nó trong các phản ứng tổng hợp hữu cơ).
- Khử oxit kim loại ở nhiệt độ cao:

3. Muối cacbonat: Axit cacbonic tạo ra hai muối là cacbonat và hiđrocacbonat.
- Muối cacbonat: chỉ có các muối của kim loại kiềm và amoni là tan tốt trong nước (riêng Li2CO3 tan vừa phải trong nước nguội và tan ít hơn trong nước nóng). Dung dịch của các muối này trong nước có xảy ra quá trình thủy phân, nên môi trường có tính kiềm (đối với muối amoni cacbonat cũng vậy).
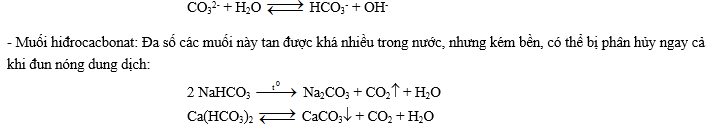
III. Trạng thái thiên nhiên:
Cacbon tồn tại ở cả dạng đơn chất và hợp chất trong tự nhiên.
Đơn chất như: than đá, kim cương, than chì.
Hợp chất như: CaCO3 (đá vôi, đá phấn, đá hoa), MgCO3 (manhêzit), CaCO3.MgCO3 (đôlômit), FeCO3 (xiđêrit), CuCO3.Cu(OH)2 (malakit).
Ngoài ra cacbon còn tồn tại một lượng lớn trong các hợp chất hữu cơ (dầu mỏ, khí đốt, ...)
IV. Silic và công nghiệp silicat
1. Silic là một trong những nguyên tố phổ biến nhất trong vỏ Trái đất (đứng hàng thứ hai sau nguyên tố oxi)
Silic có hai dạng thù hình, dạng vô định hình và dạng tinh thể. Dạng tinh thể có cấu trúc tương tự kim cương, giòn và cứng, có ánh kim dẫn điện và dẫn nhiệt kém.
Silic là nguyên tố ít hoạt động hoá học.

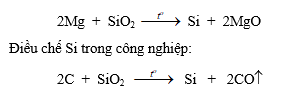
2. Hợp chất của silic
a. Silic đioxit (SiO2)
SiO2 là chất rắn không tan trong nước, khó nóng chảy (16100), có tên gọi là thạch anh. Cát trắng là những hạt thạch anh nhỏ.
SiO2 là oxit axit. ở nhiệt độ cao, SiO2 tác dụng với oxit bazơ, kiềm, cacbonat kim loại kiềm tạo ra silicat:
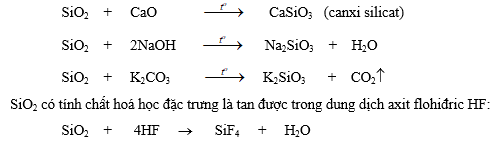
Vì vậy người ta dùng axit flohiđric để khắc hình trên thuỷ tinh.
SiO2 được dùng rộng rãi trong xây dựng, sản xuất thuỷ tinh, đá mài...
b. Axit silicic và muối silicat
Axit silicic có công thức hoá học là H2SiO3, là axit yếu, ít tan trong nước.
Điều chế axit silicic bằng cách cho axit clohiđric tác dụng với dung dịch silicat, được dung dịch H2SiO3 dưới dạng keo:
2HCl + Na2SiO3 ® H2SiO3 + 2NaCl
Muối của axit silicic có tên là silicat. Natri và kali silicat trông bề ngoài giống thuỷ tinh, nhưng tan được trong nước, vì vậy chúng có tên là thuỷ tinh tan. Dung dịch của chúng tan trong nước gọi là thuỷ tinh lỏng.
Thuỷ tinh tan dùng để chế tạo xi măng và bêtông chịu axit, dùng làm lớp bảo vệ gỗ không cháy, sản xuất silicagen. Silicagen là một polime vô cơ có công thức (SiO2)n là một chất chống ẩm rất tốt, dùng trong bảo quản phim ảnh, băng đĩa hình, thực phẩm cao cấp ...
3. Công nghiệp silicat
a. Sản xuất thủy tinh: kính, chai lọ, cốc, chén …
b. Sản xuất đồ gốm: gạch, ngói, chum, vại, bát đĩa...
c. Sản xuất xi măng
1. Có 1 lít dung dịch hỗn hợp Na2CO3 0,1 M và (NH4)2CO3 0,25 M. Cho 43 g hỗn hợp BaCl2 và CaCl2 vào dung dịch đó. Sau khi các phản ứng kết thúc thu được 39,7 g kết tủa A và dung dịch B.
1. Tính % khối lượng các chất có trong A.
2. Chia dung dịch B thành 2 phần bằng nhau:
a. Cho axit HCl vào một phần, cô cạn dung dịch và nung chất rắn còn lại tới khối lượng không đổi được chất rắn X. Tính % khối lượng các chất trong X.
b. Đun nóng phần thứ hai rồi thêm từ từ 270 ml dung dịchBa(OH)2 0,2 M vào. Hỏi tổng khối lượng của 2 dung dịch giảm tối đa bao nhiêu gam ? Giả sử nước bay hơi không đáng kể.
Cho C = 12; O = 16; Cl = 35,5 ; Ca = 40; Ba = 137.
Giải
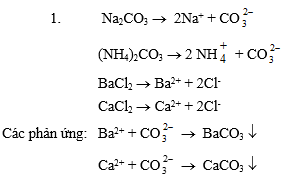
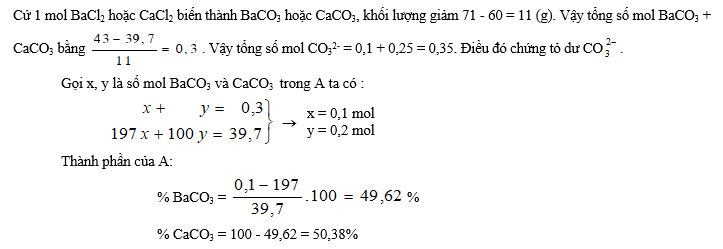
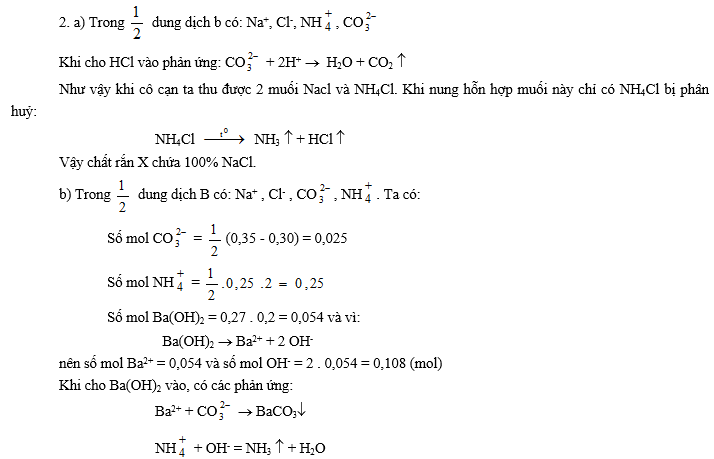
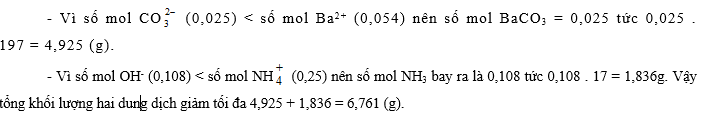
Bài 2. 1. Cho a mol CO2 tác dụng với b mol Ba(OH)2.
a. Hãy giải thích sự phụ thuộc giữa a và b theo các điều kiện sau:
b ≤ a ≤ 2b ; 2b ≤ a và b > a.
b. Khi thay Ba(OH)2 bằng NaOH thì các bất đẳng thức trên còn đúng hay không?
c. áp dụng a = 0,15 mol, b = 0,18 mol ứng với các điều kiện nào trong các điều kiện trên.
2. Hoà tan 22,95 g BaO vào nước được dung dịch A. Cho 18,4 g hỗn hợp CaCO3 và MgCO3 hoà tan hết trong dung dịch HCl thu được khí B. Nếu cho dung dịch A hấp thụ hết khí B thì có kết tủa tạo thành hay không ?
3. Nếu 14,2 g hỗn hợp hai muối trên trong đó có a% MgCO3 tác dụng với dung dịch A thì a có giá trị bằng bao nhiêu để cho lượng kết tủa có trong dung dịch là cao nhất, thấp nhất ?
Giải


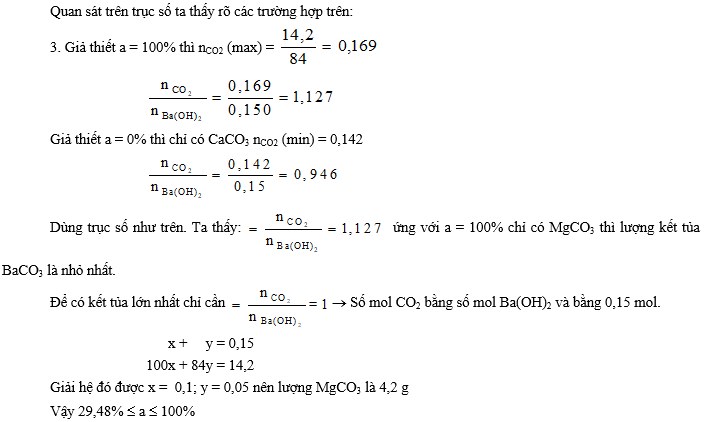
4. Hoà tan hoàn toàn 11,2 g CaO vào nước ta được dung dịch A.
1. Nếu cho khí CO2 sục qua dung dịch A và sau khi kết thúc thí nghiệm thấy có 2,5g kết tủa thì có bao nhiêu lít CO2 đã tham gia phản ứng ?
2. Nếu hoà tan hoàn toàn 28,1 g hỗn hợp MgCO3 và BaCO3 có thành phần không đổi trong đó chứa a% MgCO3 bằng dung dịch HCl và cho tất cả khí thoát ra hấp thụ hết vào dung dịch A thì thu được kết tủa D. Hỏi khi a có giá trị bao nhiêu thì lượng kết tủa D nhiều nhất và ít nhất.
Cho: C = 12 ; O = 16 ; Mg = 24 ; Ca = 40 ; Ba = 137.
Giải

Tóm lại: 0,14 ≤ nCO2 ≤ 0,33.
- Nếu nCO2 = 0,14 < nCa(OH)2, tức là không có phản ứng (3) và nCaCO3 = nCO2 = 0,14.
- Nếu nCO2 = 0,33 > nCa(OH)2, tức là xảy ra phản ứng (2) và (3) nên lượng kết tủa bằng: nCaCO3 = 0,2 - (0,33 – 0,2) = 0,07 (mol).
Vậy khi a = 100% thì lượng kết tủa bé nhất.
Ý kiến bạn đọc
Bạn cần đăng nhập với tư cách là Thành viên chính thức để có thể bình luận
Những tin cũ hơn
global video
-
-
 Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
-
 Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
-
 Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Thăm dò ý kiến
Tin xem nhiều
-
 Bài tập về thấu kính hội tụ
Bài tập về thấu kính hội tụ
-
 DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
-
 ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
-
 ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
-
 Bài tập về thấu kính phân kỳ
Bài tập về thấu kính phân kỳ
-
 Dạng bài tập về Đoạn mạch nối tiếp
Dạng bài tập về Đoạn mạch nối tiếp
-
 Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
-
 Dạng bài tập đoạn mạch song song
Dạng bài tập đoạn mạch song song
-
 CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
-
 TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
Thống kê
- Đang truy cập60
- Hôm nay23,846
- Tháng hiện tại743,760
- Tổng lượt truy cập18,831,944
Tài liệu mới
- chuyên đề Phương trình... - 18/04/2022
- Phương trình chứa ấn ở... - 28/02/2020
- Các dạng bài tập phương... - 28/02/2020
- Giáo án dạy thêm toán 6 - 27/02/2020
- Chuyên đề bồi dưỡng học... - 27/02/2020
