PHẢN ỨNG OXI HÓA – KHỬ
A. LÍ THUYẾT CƠ BẢN VÀ NÂNG CAO
I. PHẢN ỨNG OXI HOÁ - KHỬ
1. Số oxi hoá
I. PHẢN ỨNG OXI HOÁ - KHỬ
1. Số oxi hoá

Số oxi hoá của một nguyên tố trong phân tử là điện tích của nguyên tử nguyên tố đó trong phân tử, nếu giả định rằng liên kết giữa các nguyên tử trong phân tử là liên kết ion.
Số oxi hoá được xác định theo các nguyên tắc sau:

2. Phản ứng oxi hoá - khử
Chất khử là chất nhường electron hay là chất có số oxi hoá tăng sau phản ứng. Chất khử còn được gọi là chất bị oxi hoá.
Chất oxi hoá là chất nhận electron hay là chất có số oxi hoá giảm sau phản ứng. Chất oxi hoá còn được gọi là chất bị khư.
Sự oxi hóa (quá trình oxi hoá) một chất là làm cho chất đó nhận electron hay làm tăng số oxi hoá của chất đó.
Sự khứ (quá trình khử) một chất là làm cho chất đó nhận electron hay làm giảm số oxi hoá của chất đó.
Phản ứng oxi hoá - khử là phản ứng hoá học trong đó có sự chuyên electron giữa các chất (nguyên tử, phân tử hoặc ion) phản ứng , hay phản ứng oxi hoá - khứ là phản ứng hoá học trong đó có sự thay đổi số oxi hoá của một số nguyên tố.
Thí dụ:
0 +2 +2 0
Fe + CuSO4 → FeSO4 + Cu
Chất khử: Fe
Chất oxi hoá: CuSO4
Sự khử: Cu+2 + 2e → Cu
Sự oxi hoá: Fe → Fe+2 + 2e
II. CÁC PHƯƠNG PHÁP CÂN BẰNG PHẢN ỨNG OXI HOÁ - KHỬ
1. Nguyên tắc chung
Tổng số electron của chất khử cho bằng tổng số electron của chất oxi hoá nhận, hay nói cách khác, tông độ tăng số oxi hoá của chất khí bằng tổng độ giảm số oxi hoá của chất oxi hoá.
2. Phương pháp thăng bằng electron
Tiến hành theo 4 bước:
Bước 1: Viết sơ đồ phản ứng, xác định chất oxi hoá, chất khử (dựa vào sự thay đổi số oxi hoá của các nguyên tố).
Bước 2: Viết các nửa phương trình cho nhận electron. Tìm hệ số cân bằng số electron cho – nhận.
Bước 3: Đặt hệ số tìm được từ nửa phương trình cho – nhận electron vào các chất oxi hoá, chất khử tương ứng trong phương trình phản ứng.
Bước 4: Cân bằng chất không tham gia quá trình oxi hoá - khử (nếu có) theo trật tự sau: Số nguyên tử kim loại, gốc axit, Số phân tử môi trường (axit hoặc kiểm) và cuối cùng là số lượng phân tử nước tạo thành. Kiểm tra kết quả.
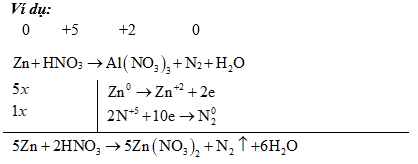
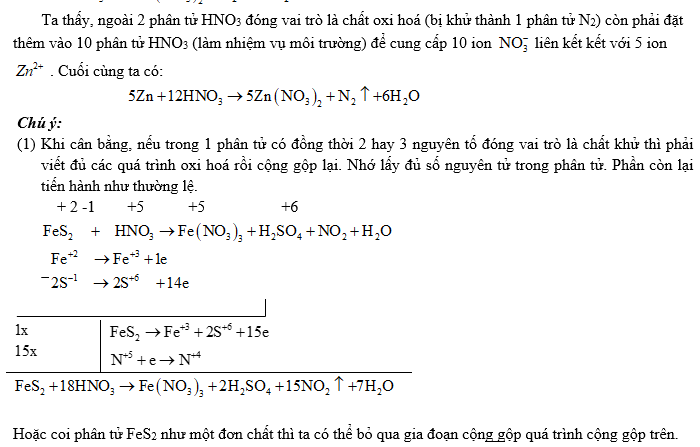
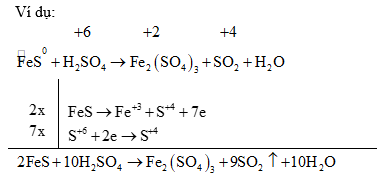
(2) Đối với các phản ứng tạo ra nhiều sản phẩm (của sự oxi hoá hay sự khử) trong đó có nhiều số oxi hoá khác nhau thì có thể viết riêng từng bán phản ứng oxi hoá đối với mỗi sản phẩm khử, rồi viết gộp lại sau khi đã nhân với hệ số tỉ lệ giữa các sản phẩm. Ví dụ:
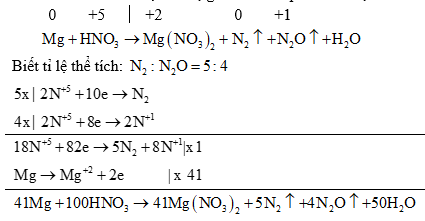
(3) Đối với phản ứng oxi hóa – khử có hệ số bằng chữ thì cần xác định đúng sự tăng, giảm số oxi hóa của các nguyên tố.
Ví dụ 1: Cân bằng phản ứng oxi hóa - khử sau:
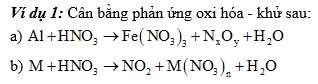
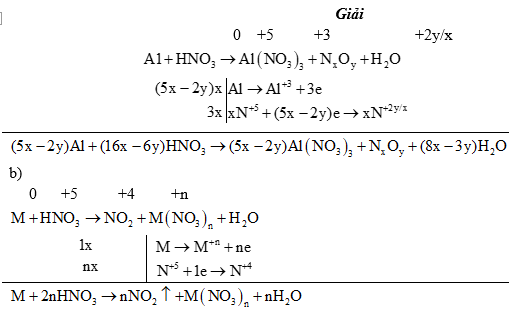
4) Ảnh hưởng của môi trường: Trong một số chất thì tác nhân oxi hóa, tác nhân khử phụ thuộc vào môi trường tiến hành phản ứng.
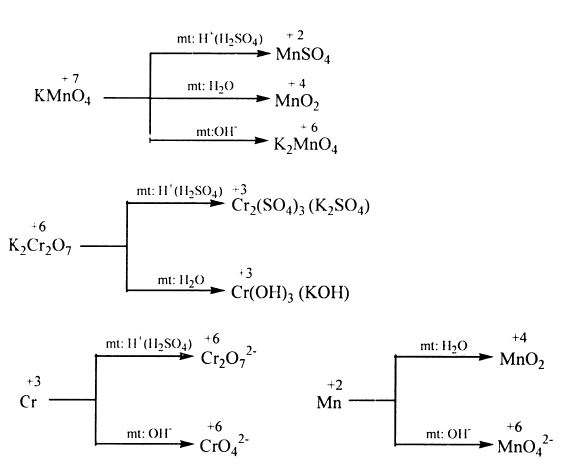

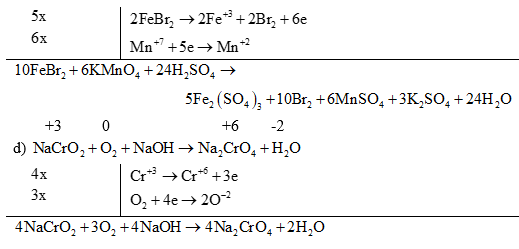
•Oxi hoá kim loại
Sản phẩm khử phụ thuộc vào tính khử của kim loại, nồng độ của axit, nhiệt độ tiến hành phản ứng,... Nói chung thì axit bị khử xuống bậc oxi hóa càng thấp khi nồng độ càng loãng và tác dụng với kim loại càng mạnh:
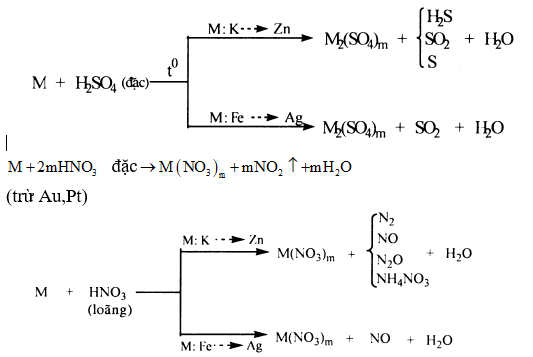
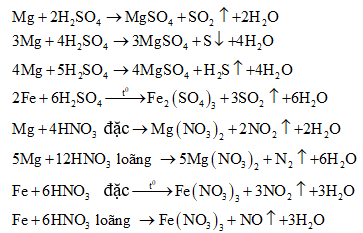
Chú ý:
(1) m là hóa trị cao của M.
(2) Một số kim loại như Al, Fe, Cr,... bị thụ động hóa trong H2SO4 đặc, nguội và HNO3 đặc, nguội.
3) Hỗn hợp HNO3 đặc và HCl đặc theo tỉ lệ thể tích 1:3 gọi là nước cường thủy. Có tính oxi hóa rất mạnh có thể hòa tan Au và Pt.
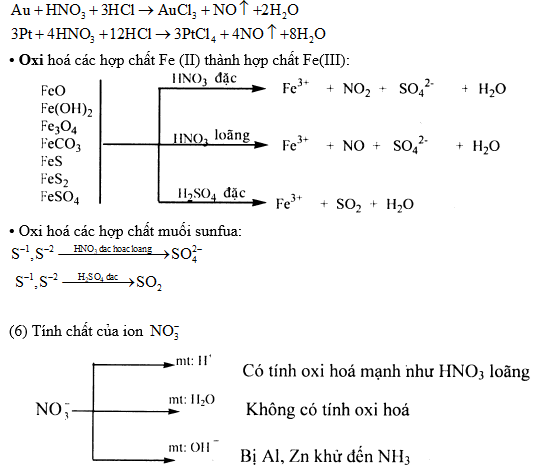
3. Phương pháp ion – electron
Cách cân bằng này chỉ áp dụng cho các phản ứng oxi hoá - khử xảy ra trong dung dịch, có sự tham gia của môi trường (axit, bazơ, nước).
Khi cân bằng cũng áp dụng theo 4 bước trên, nhưng ở bước 2 chất oxi hoá và chất khử được viết dưới dạng ion – electron theo các nguyên tắc sau đây:
a) Nếu phản ứng có axit tham gia: Vế nào thừa oxi ta thêm H+ để tạo ra H2O và ngược lại.
Ví dụ.
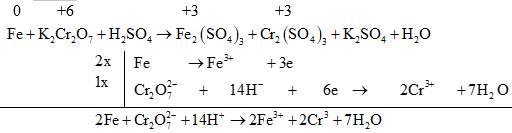
Để biết phương trình có cân bằng đúng hay không, bạn đọc cần tính tổng điện tích hai vế của phương trình ion thu gọn. Nếu tổng điện tích hai vế của phương trình bằng nhau thì phương trình đã được cân bằng.
Phương trình phân tử:
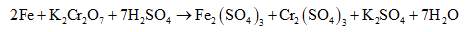
Lưu ý: Để viết nhanh các bán phản ứng khử hoặc bán phản ứng oxi hoá có thể áp dụng phương pháp bảo toàn điện tích (hay điện tích giả định) hai về.


2. Nếu phin ng có bữ tham gia: Vế nào thừa oxi thêm nước để tạo ra OH- và ngược lại.
Ví dụ:
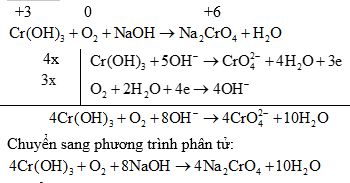
3. Nếu phản ứng có H2O tham gia
• Sản phẩm phản ứng tạo ra axit, theo nguyên tắc 1.
• Sản phẩm phản ứng tạo ra bazơ, theo nguyên tắc 2.
Ví dụ:
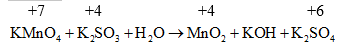
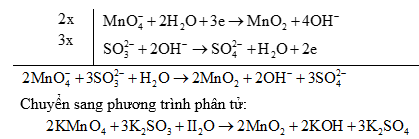
Ưu việt của phương pháp này là cho ta hoàn thành chính xác các phương trình phản ứng dưới dạng ion thu gọn (bản chất của các phản ứng) nếu biết được trạng thái đầu và trạng thái cuối của dạng oxi hoá và dạng khử.
Ví dụ: Hoàn thành và cân bằng các phản ứng sau dưới dạng ion thu gọn:
a) Cu + NaNO3 + HCl →
b) Al + NaNO3 + NaOH →
c) FeS + HNO3 loãng →
Giải

d) Phương pháp cân bằng phản ứng oxi hoá - khử có chất hữu cơ tham gia
Tương tự đối với chất vô cơ, phản ứng oxi hoá - khử có chất hữu cơ cũng tiến hành theo 4 bước. Nhưng ở bước (1) khi tính số oxi hoá của C cần lưu ý theo phư ơng pháp sau:
• Phương pháp chung: Tính số oxi hoá trung bình của C.
• Phương pháp riêng. Đặc biệt đối với những phản ứng chi có sự thay đổi nhóm chức, có thể tính số oxi hoá của C nào có sự thay đổi số oxi hoá.
Ví dụ:
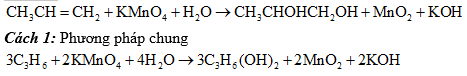

Số oxi hoá được xác định theo các nguyên tắc sau:

2. Phản ứng oxi hoá - khử
Chất khử là chất nhường electron hay là chất có số oxi hoá tăng sau phản ứng. Chất khử còn được gọi là chất bị oxi hoá.
Chất oxi hoá là chất nhận electron hay là chất có số oxi hoá giảm sau phản ứng. Chất oxi hoá còn được gọi là chất bị khư.
Sự oxi hóa (quá trình oxi hoá) một chất là làm cho chất đó nhận electron hay làm tăng số oxi hoá của chất đó.
Sự khứ (quá trình khử) một chất là làm cho chất đó nhận electron hay làm giảm số oxi hoá của chất đó.
Phản ứng oxi hoá - khử là phản ứng hoá học trong đó có sự chuyên electron giữa các chất (nguyên tử, phân tử hoặc ion) phản ứng , hay phản ứng oxi hoá - khứ là phản ứng hoá học trong đó có sự thay đổi số oxi hoá của một số nguyên tố.
Thí dụ:
0 +2 +2 0
Fe + CuSO4 → FeSO4 + Cu
Chất khử: Fe
Chất oxi hoá: CuSO4
Sự khử: Cu+2 + 2e → Cu
Sự oxi hoá: Fe → Fe+2 + 2e
II. CÁC PHƯƠNG PHÁP CÂN BẰNG PHẢN ỨNG OXI HOÁ - KHỬ
1. Nguyên tắc chung
Tổng số electron của chất khử cho bằng tổng số electron của chất oxi hoá nhận, hay nói cách khác, tông độ tăng số oxi hoá của chất khí bằng tổng độ giảm số oxi hoá của chất oxi hoá.
2. Phương pháp thăng bằng electron
Tiến hành theo 4 bước:
Bước 1: Viết sơ đồ phản ứng, xác định chất oxi hoá, chất khử (dựa vào sự thay đổi số oxi hoá của các nguyên tố).
Bước 2: Viết các nửa phương trình cho nhận electron. Tìm hệ số cân bằng số electron cho – nhận.
Bước 3: Đặt hệ số tìm được từ nửa phương trình cho – nhận electron vào các chất oxi hoá, chất khử tương ứng trong phương trình phản ứng.
Bước 4: Cân bằng chất không tham gia quá trình oxi hoá - khử (nếu có) theo trật tự sau: Số nguyên tử kim loại, gốc axit, Số phân tử môi trường (axit hoặc kiểm) và cuối cùng là số lượng phân tử nước tạo thành. Kiểm tra kết quả.
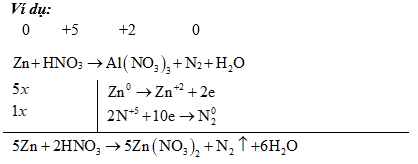
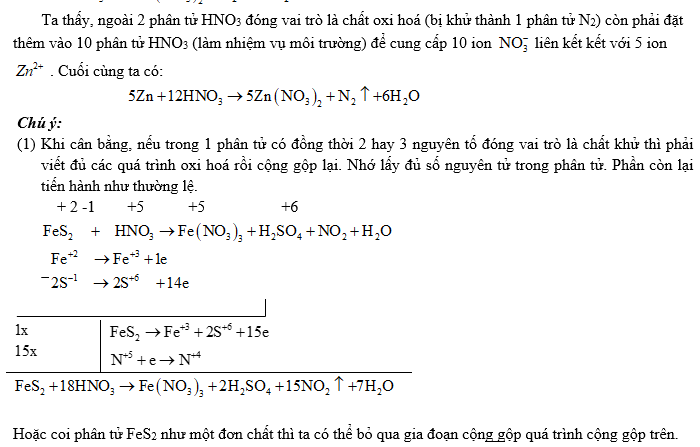
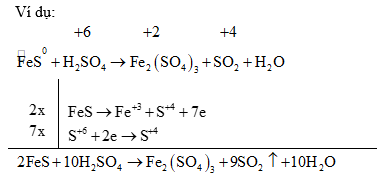
(2) Đối với các phản ứng tạo ra nhiều sản phẩm (của sự oxi hoá hay sự khử) trong đó có nhiều số oxi hoá khác nhau thì có thể viết riêng từng bán phản ứng oxi hoá đối với mỗi sản phẩm khử, rồi viết gộp lại sau khi đã nhân với hệ số tỉ lệ giữa các sản phẩm. Ví dụ:
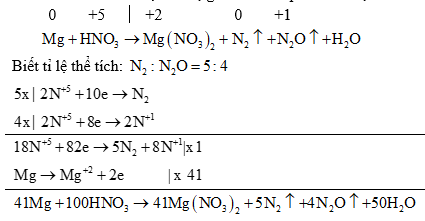
(3) Đối với phản ứng oxi hóa – khử có hệ số bằng chữ thì cần xác định đúng sự tăng, giảm số oxi hóa của các nguyên tố.
Ví dụ 1: Cân bằng phản ứng oxi hóa - khử sau:
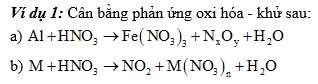
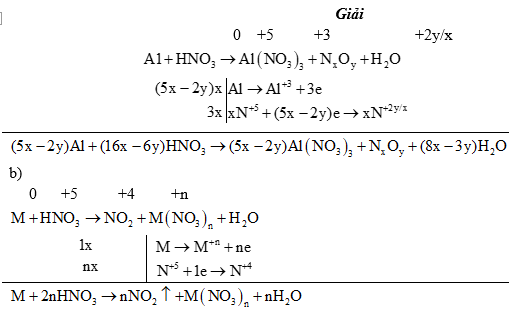
4) Ảnh hưởng của môi trường: Trong một số chất thì tác nhân oxi hóa, tác nhân khử phụ thuộc vào môi trường tiến hành phản ứng.


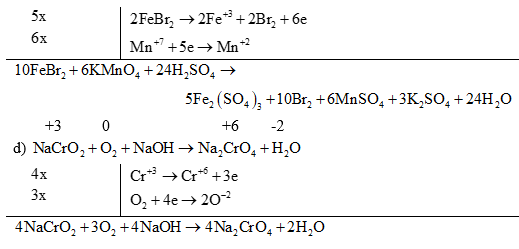
•Oxi hoá kim loại
Sản phẩm khử phụ thuộc vào tính khử của kim loại, nồng độ của axit, nhiệt độ tiến hành phản ứng,... Nói chung thì axit bị khử xuống bậc oxi hóa càng thấp khi nồng độ càng loãng và tác dụng với kim loại càng mạnh:

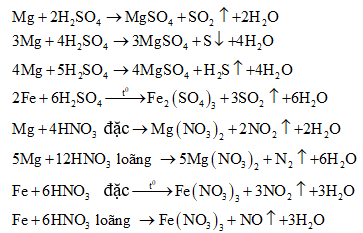
Chú ý:
(1) m là hóa trị cao của M.
(2) Một số kim loại như Al, Fe, Cr,... bị thụ động hóa trong H2SO4 đặc, nguội và HNO3 đặc, nguội.
3) Hỗn hợp HNO3 đặc và HCl đặc theo tỉ lệ thể tích 1:3 gọi là nước cường thủy. Có tính oxi hóa rất mạnh có thể hòa tan Au và Pt.

3. Phương pháp ion – electron
Cách cân bằng này chỉ áp dụng cho các phản ứng oxi hoá - khử xảy ra trong dung dịch, có sự tham gia của môi trường (axit, bazơ, nước).
Khi cân bằng cũng áp dụng theo 4 bước trên, nhưng ở bước 2 chất oxi hoá và chất khử được viết dưới dạng ion – electron theo các nguyên tắc sau đây:
a) Nếu phản ứng có axit tham gia: Vế nào thừa oxi ta thêm H+ để tạo ra H2O và ngược lại.
Ví dụ.
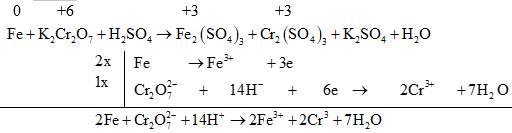
Để biết phương trình có cân bằng đúng hay không, bạn đọc cần tính tổng điện tích hai vế của phương trình ion thu gọn. Nếu tổng điện tích hai vế của phương trình bằng nhau thì phương trình đã được cân bằng.
Phương trình phân tử:
Lưu ý: Để viết nhanh các bán phản ứng khử hoặc bán phản ứng oxi hoá có thể áp dụng phương pháp bảo toàn điện tích (hay điện tích giả định) hai về.


2. Nếu phin ng có bữ tham gia: Vế nào thừa oxi thêm nước để tạo ra OH- và ngược lại.
Ví dụ:

3. Nếu phản ứng có H2O tham gia
• Sản phẩm phản ứng tạo ra axit, theo nguyên tắc 1.
• Sản phẩm phản ứng tạo ra bazơ, theo nguyên tắc 2.
Ví dụ:
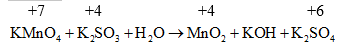
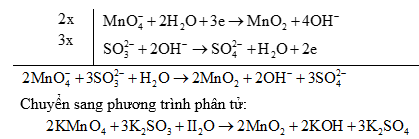
Ưu việt của phương pháp này là cho ta hoàn thành chính xác các phương trình phản ứng dưới dạng ion thu gọn (bản chất của các phản ứng) nếu biết được trạng thái đầu và trạng thái cuối của dạng oxi hoá và dạng khử.
Ví dụ: Hoàn thành và cân bằng các phản ứng sau dưới dạng ion thu gọn:
a) Cu + NaNO3 + HCl →
b) Al + NaNO3 + NaOH →
c) FeS + HNO3 loãng →
Giải

d) Phương pháp cân bằng phản ứng oxi hoá - khử có chất hữu cơ tham gia
Tương tự đối với chất vô cơ, phản ứng oxi hoá - khử có chất hữu cơ cũng tiến hành theo 4 bước. Nhưng ở bước (1) khi tính số oxi hoá của C cần lưu ý theo phư ơng pháp sau:
• Phương pháp chung: Tính số oxi hoá trung bình của C.
• Phương pháp riêng. Đặc biệt đối với những phản ứng chi có sự thay đổi nhóm chức, có thể tính số oxi hoá của C nào có sự thay đổi số oxi hoá.
Ví dụ:
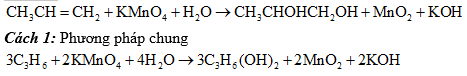

Ý kiến bạn đọc
Bạn cần đăng nhập với tư cách là Thành viên chính thức để có thể bình luận
Những tin mới hơn
Những tin cũ hơn
global video
-
-
 Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
-
 Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
-
 Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Thăm dò ý kiến
Tin xem nhiều
-
 Bài tập về thấu kính hội tụ
Bài tập về thấu kính hội tụ
-
 DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
-
 ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
-
 ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
-
 Bài tập về thấu kính phân kỳ
Bài tập về thấu kính phân kỳ
-
 Dạng bài tập về Đoạn mạch nối tiếp
Dạng bài tập về Đoạn mạch nối tiếp
-
 Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
-
 Dạng bài tập đoạn mạch song song
Dạng bài tập đoạn mạch song song
-
 CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
-
 TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
Thống kê
- Đang truy cập81
- Hôm nay23,173
- Tháng hiện tại743,087
- Tổng lượt truy cập18,831,271
Tài liệu mới
- chuyên đề Phương trình... - 18/04/2022
- Phương trình chứa ấn ở... - 28/02/2020
- Các dạng bài tập phương... - 28/02/2020
- Giáo án dạy thêm toán 6 - 27/02/2020
- Chuyên đề bồi dưỡng học... - 27/02/2020
