I. Cấu tạo nguyên tử, tính chất của đơn chất halogen
1. Cấu hình electron nguyên tử
Flo, clo, brom và iot có cấu hình electron như sau:
Flo, clo, brom và iot có cấu hình electron như sau:

F:[He]2s22p5; Cl:[Ne]2s22p5; Br :[Ar]2s22p5; I:[Kr]2s22p5
Giống nhau: Lớp electron ngoài cùng của nguyên tử các halozen có 7 electron và có cấu hình ns2np5.
Khác nhau: Từ flo qua clo đến brom và iot, bán kính nguyên tử tăng dần lớp electron ngoài cùng càng xa hạt nhân hơn, lực hút của hạt nhân đối với lớp electron ngoài cùng càng yếu hơn.
Lớp electron ngoài cùng : ở flo không có phân lớp d, các halogen khác có phân lớp d còn trống.
Trong nhóm halogen , độ âm điện giảm dần từ flo đến iot
3. Tính chất hoá học
Cl2 + H2O ® HCl + HclO
3Cl2 + 2Fe ® 2FeCl3
Cl2 + 2NaBr ® 2NaCl + Br2
Clo không tác dụng trức tiếp với oxi.
II. Hợp chất của halogen

Nước Giaven, clorua vôi, muối clorat
Clo tác dụng với dung dịch natri hiđroxit loãng, nguội tạo ra nước Giaven: NaCl, NaClO, H2O.
Khi điện phân dung dịch NaCl, không có màng ngăn giữa cực âm và cực dương, clo tạo thành ở cực dương sẽ tác dụng với natri hiđroxit tạo thành nước Giaven. Do tính chất oxi hoá mạnh, nước Giaven được dùng để tẩy trắng sợi, vải, giấy, sát trùng và khử mùi các khu vực bị ô nhiễm.

Clorua vôi là muối hỗn tạp của canxi với hai gốc axit khác nhau.
So với nước Giaven, clorua vôi có giá thành rẻ hơn, dễ chuyên chở hơn nên được sử dụng rộng rãi làm chất tẩy trắng, sát trùng, khử ô nhiễm bảo vệ môi trường.
Muối clorat là muối của axit HClO3. Muối clorat quan trọng hơn cả là KClO3.
Điều chế:
3Cl2 + 6KOH ® 5KCl + KClO3 + 3H2O
Trong công nghiệp muối kali clorat được điều chế bằng cách điện phân dung dịch KCl 25% ở nhiệt độ 70 - 75oC.
Muối kali clorat tan nhiều trong nước nóng, ít tan trong nước lạnh. Vì vậy, khi làm lạnh dung dịch bão hoà, muối kali clorat dễ dàng tách ra khỏi dung dịch.
Muối kali clorat được sử dụng để điều chế oxi trong phòng thí nghiệm, sản xuất pháo hoa, thuốc nổ. Thuóc gắn ở đầu que diêm thường chứa 50% muối kali clorat.
Câu 2: Có hỗn hợp gồm NaI và NaBr. Hoà tan hỗn hợp vào nước. Cho brom dư vào dung dịch. Sau khi phản ứng thực hiện xong làm bay hơi dung dịch, làm khô sản phẩm thì thấy khối lượng của sản phẩm nhỏ hơn khối lượng hỗn hợp hai muối ban đầu là m gam.
Lại hoà tan sản phẩm vào nước và cho clo lội qua cho đến dư. Làm bay hơi dung dịch và làm khô chất còn lại; người ta thấy khối lượng chất thu được nhỏ hơn khối lượng muối phản ứng là m gam.
Xác định phần trăm về khối lượng của NaBr trong hỗn hợp đầu.
Đáp án: NaBr = 3,7%
Gọi x là số mol NaI, y là số mol NaBr trong hỗn hợp.
2NaI + Br2 = 2NaBr + I2 (khi làm khô thì iôt thăng hoa)
1mol 1mol
(150g) (103g) khối lượng giảm đi 47g so với khối lượng muối ban đầu
x mol x mol ……………………47x = m (1)
2NaBr + Cl2 = 2NaCl + Br2
1mol 1mol
(103g) (58,5g) khối lượng giảm đi 44,5g
(x + y) mol (x + y) mol……………………44,5(x + y) = m (2)
Kết hợp (1) và (2) ta có:
47x = 44,5 (x + y) → x : y = 17,8 : 1
Điều đó có nghĩa là, nếu NaI là 17,8 mol thì NaBr là 1 mol
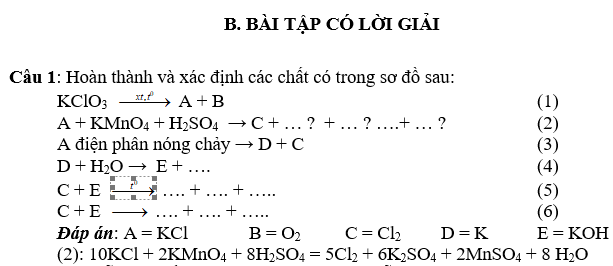
Phần trăm về khối lượng của NaBr trong hỗn hợp:
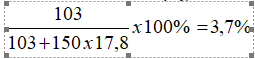
Câu 3: Gây phản ứng nổ một hỗn hợp 5,6 lít khí H2 và Cl2 (đktc) trong một bình kín, rồi cho toàn bộ sản phẩm tác dụng với dung dịch NaOH vừa đủ, cho ra dung dịch có thể tích bằng 200ml và tổng nồng độ các muối tan là 1,5M. Tính phần trăm thể tích của Cl2 và H2 trong hỗn hợp đầu (phản ứng với NaOh ở nhiệt độ thường).
Đáp án: Toàn bộ sản phẩm tác dụng hết với NaOH → không còn H2 sau phản ứng, nghĩa là hiệu suất 100%.
Vậy có hai trường hợp:
a. Cl2 và H2 phản ứng vừa đủ suy ra
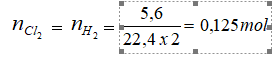
H2 + Cl2 → 2HCl
0,125 0,125 0,25 (mol)
Sản phẩm chỉ có HCl
HCl + NaOH → NaCl + H2O
0,25 0,25 (mol)
Nếu vậy, nồng độ muối trong dung dịch là nồng độ của NaCl và phải là:

b. Cl2 dư H2 hết:
Đặt trong hỗn hợp đầu
Số mol H2: a mol ; số mol Cl2: b mol
H2 + Cl2 → 2HCl
Ban đầu a b (mol)
Phản ứng a a 2a
Sau phản ứng 0 (b – a) 2a
- Sản phẩm (HCl, Cl2 dư) + NaOH:
HCl + NaOH → NaCl + H2O
2a 2a
Cl2 + NaOH → NaCl + NaClO + H2O
(b – a) (b – a) (b – a)
Ta có: a + b = 0,25 (1)
2a + (b – a) + (b – a) = 1,5 x 0,2 = 0,3 hay 2b = 0,3 (2)
Từ (1), (2) → a = 0,1; b = 0,15
Vì %V = % n →

Câu 4: Có một loại đá X chứa a% Al2O3, b% Fe2O3, phần trăm còn lại là hỗn hợp CaCO3 và MgCO3. Lấy một mẫu đá X nung ở nhiệt độ cao một thời gian thu được chất rắn Y có khối lượng bằng 82% khối lượng đá khi nung. Để hoà tan hoàn toàn 10gam chất rắn Y tiêu tốn 173ml dung dịch HCl 2M. Mặt khác nung mẫu đá X tới khối lượng không đổi (phân huỷ hoàn toàn các muối cacbonat) thu được chất rắn Z.
Lập biểu thức tính % khối lượng của Z so với khối lượng đá trước khi nung.
Áp dụng: a = 10,2%; b = 16%
Đáp án: Các phản ứng xảy ra khi nung X
CaCO3 CaO + CO2 (1)
CaO + CO2 (1)
MgCO3 MgO + CO2 (2)
MgO + CO2 (2)
Các phản ứng xảy ra khi hoà tan Y:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 (3)
CaO + 2HCl → CaCl2 + H2O (4)
MgCO3 + 2HCl → MgCl2 + H2O + CO2 (5)
MgO + 2HCl → MgCl2 + H2O (6)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (7)
Fe2O3 + 6HCl → FeCl3 + 3H2O (8)
Giả sử ban đầu có 100 gam đá X, trong đó a gam Al2O3, b gam Fe2O3, x mol CaCO3 và y mol MgCO3. Theo các phản ứng (1, 2, 3, 4, 5, 6) thì tổng số mol HCl tham gia các phản ứng (3, 4, 5, 6) cũng bằng tổng số mol HCl phản ứng với CaCO3, MgCO3 có trong nước khi nung. (vì 1 mol CaCO3 hoặc MgCO3 tạo ra 1 mol CaO hoặc MgO thì lượng HCl tiêu tốn như nhau. Mặt khác, muốn hoà tan cả 82 gam chất rắn Y cần dùng:

Câu 5:
1. Tính % lượng AgCl bị mất đi sau khi rửa 0,451g hợp chất này bằng:
a. 200ml nước cất
b. 150ml NH4Cl 0,1M. Rồi bằng 50ml nước cất
2. Dùng 200ml dd NH4NO3 để rửa kết tủa MgNH4PO4. Hãy tính nồng độ C% cua dd NH4NO3 để khi rửa kết tủa không mất quá 0,01g magiê oxit.
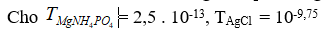
Dung dịch loãng NH4NO3 xem như D » 1 g/ml
Đáp án:


Câu 6: Giải thích và viết các phương trình phản ứng nếu có:
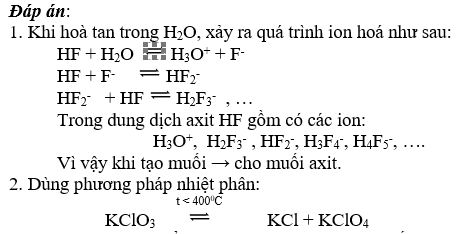
1. Tại sao axit HF tạo được muối axit còn các axit HX khác không có khả năng đó?
2. Đề nghị phương pháp điều chế KClO4 từ KClO3.
3. Tại sao Iốt không tạo ra hợp chất với clo tương tự hợp chất IF7.
4. Nguyên nhân hình thành tinh thể Cl2.8H2O, hiđrat đó có phải là hợp chất hoá học không?
5. Viết phương trình phản ứng khi clo Cl2 tác dụng với:
- Dung dịch Natri hiđroxit
- Dung dịch KI
- Dung dịch Natri thiosunfat.
Hoà tan sản phẩm vào nước. Sau đó tác 2 chất trên bằng phương pháp kết tinh phân (dựa vào độ tan khác nhau).
3. I (Z = 53) …. 5s25p5. Do năng lượng kích thích nguyên tử cần thiết để hình thành các electron không cặp đôi giảm dần từ Clo → Iôt. Đồng thời theo chiều từ Clo → Iôt bán kính nguyên tử tăng, nên số nguyên tử Flo có thể phân bố được nhiều hơn xung quanh nguyên tử có kích thước lớn.
4. Nguyên nhân là do trong tinh thể nước đá các phân tử H2O liên kết với nhau bằng liên kết hiđro, giữa các phân tử có khoảng trống nên áp suất cao Cl2 đã thâm nhập vào các khoảng trống đó tạo tinh thể hiđrat Cl2.8H2O. Do vậy lực tương tác giữa Cl2 và H2O là lực khuếch tán → lực này không đủ lớn để hình thành phân tử hợp chất hoá học → Cl2.8H2O không phải là hợp chất hoá học.
5. Phương trình phản ứng:
Cl2 + NaOH = NaCl + NaClO + H2O
Cl2 + 2KI = I2 + 2KCl
5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl
Na2S2O3 + 4Cl2 + 5H2O = 2NaHSO4 + 8HCl
Câu 7: Cân bằng phương trình phản ứng sau (viết phản ứng 2 ở dạng tổng quát):
1. Cl2 + NaOH → NaClO3 + NaCl + H2O
2. M2Ox + HNO3 → M(NO3)3 + NO + H2O
- Viết phản ứng 1 dưới dạng phương trình ion rút gọn.
- Với giá trị nào của x phản ứng 2 sẽ là phản ứng oxi hoá - khử hoặc phản ứng trao đổi?
Câu 8: Có một hỗn hợp gồm NaCl và NaBr, trong đó NaBr chiếm 10% về khối lượng. Hoà tan hỗn hợp vào nước rồi cho khí clo lội qua dung dịch cho đến dư. Làm bay hơi dung dịch cho tới khi thu được muối khan (muối không ngậm nước). Khối lượng hợp ban đầu đã thay đổi bao nhiêu %.
Đáp án:
Hỗn hợp NaCl và NaBr có 10% NaBr, tính tỉ lệ nguyên tố Br trong hỗn hợp và khối lượng Br thay bằng Cl. Tính khối lượng ban đầu còn, tính tỉ lệ thay đổi là 4,32%.
Câu 9: Hỗn hợp A gồm 3 muối NaCl, NaBr và NaI:
- 5,76 gam A tác dụng với lượng dư dung dịch brom, cô cạn thu được 5,29 gam muối khan.
- Hoà tan 5,76 gam A vào nước rồi cho một lượng khí clo sục qua dung dịch. Sau một thời gian, cô cạn thì thu được 3,955 gam muối khan, trong đó có 0,05 mol ion clorua.
a. Viết các phương trình phản ứng.
b. Tính thành phần phần trăm khối lượng mỗi muối trong A.
Đáp án:
Đặt số mol NaCl: a; NaBr: b; NaI: c
a/ Các phản ứng với brom dư:

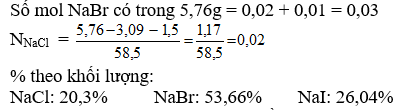
Câu 10: A, B là hai dung dịch HCl có nồng độ mol khác nhau. Nếu trộn V1 lít A với V2 lít B rồi cho tác dụng với 1,768 gam hỗn hợp kim loại gồm Fe, Al và Cu thì thấy vừa đủ để hoà tan các kim loại hoạt động có trong hỗn hợp và khi đó thu được 0,016 mol H2 đktc. Lượng Cu không tan đem oxi hoá rồi hoà tan thì cũng cần một lượng axit HCl vừa đúng như trên. Biết V1 + V2 = 0,052 lít, nồng độ mol của B lớn gấp 4 của A và V2/2 lít B hoà tan vừa hết 1/6 lượng Fe của hỗn hợp.
a. Viết các phương trình phản ứng và tính phần trăm theo khối lượng của các kim loại trong hỗn hợp.
b. Tính nồng độ mol của A và B. Giả thiết các phản ứng xảy ra hoàn toàn.
Đáp án:
a. Đặt a, b là nồng độ của HCl trong dung dịch A và B. Đặt x, y, z là số mol FE, Al, Cu.
Số mol HCl sau khi trộn = (V1a + V2b) mol
Viết các phương trình phản ứng của Fe và Al tác dụng với H+; Cu tác dụng với H+ và O2.

Câu 11:
a. Hai cốc đựng axit clohiđric đặt trên hai đĩa cân A và B. Cân ở trạng thái thăng bằng. Cho a gam CaCO3 vào cốc A và b gam M2CO3 (M là kim loại kiềm) vào cốc B. Sau khi hai muối đã phản ứng hết và tan hoàn toàn, cân trở lại vị trí thăng bằng.
(1) Tính tổng khối lượng muối khan thu được biết M có hoá trị 2 trong các muối này.
(2)Xác định kim loại M nếu biết số mol tham gia phản ứng của hai kim loại bằng nhau.
Cho H = 1; C = 12; O = 16; S = 32; Cl = 35,5; Ca = 40
Đáp án:
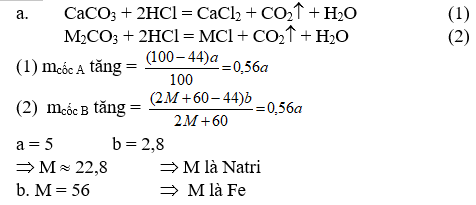
Giống nhau: Lớp electron ngoài cùng của nguyên tử các halozen có 7 electron và có cấu hình ns2np5.
Khác nhau: Từ flo qua clo đến brom và iot, bán kính nguyên tử tăng dần lớp electron ngoài cùng càng xa hạt nhân hơn, lực hút của hạt nhân đối với lớp electron ngoài cùng càng yếu hơn.
Lớp electron ngoài cùng : ở flo không có phân lớp d, các halogen khác có phân lớp d còn trống.
- Các halogen có độ âm điện lớn.
Trong nhóm halogen , độ âm điện giảm dần từ flo đến iot
3. Tính chất hoá học
- Halogen là những phi kim có tính oxi hoá mạnh : Halogen oxi hoá hầu hết các kim loại, nhiều phi kim và nhiều hợp chất. Khi đó nguyên tử halogen biến thành ion halogenua với số oxi hoá -1.
Cl2 + H2O ® HCl + HclO
3Cl2 + 2Fe ® 2FeCl3
Cl2 + 2NaBr ® 2NaCl + Br2
Clo không tác dụng trức tiếp với oxi.
- Tính oxi hoá của halogen giảm dần từ flo đến iot.
- Flo không thể hiện tính khử, các halogen khác thể hiện tính khử và tính khử tăng dần từ clo đến iot.
- Trong phòng thí nghiệm: Dùng dung dịch axit HCl đặc tác dụng với một chất oxi hoá như KMnO4, MnO2, K2Cr2O7 …
- Trong công nghiệp: Sản xuất khí clo bằng cách điện phân dung dịch muối ăn bão hoà có màng ngăn.
II. Hợp chất của halogen
- Hiđro halogenua và axit halogenhiđric HF, HCl, HBr, HI
- hiđro halogenua là các hợp chất khí, dễ tan trong nước tạo ra các dung dịch axit halogenhiđric.
- Từ HF đến HI tính chất axit tăng dần, HF là một axit yếu.
- Từ HF đến HI tính chất khử tăng dần, chỉ có thể oxi hoá F- bằng dòng điện, trong khi đó các ion âm khác như Cl-, Br-, I- đều bị oxi hoá khi tác dụng với chất oxi hoá mạnh.
- Hợp chất có oxi của halogen

Nước Giaven, clorua vôi, muối clorat
Clo tác dụng với dung dịch natri hiđroxit loãng, nguội tạo ra nước Giaven: NaCl, NaClO, H2O.
Khi điện phân dung dịch NaCl, không có màng ngăn giữa cực âm và cực dương, clo tạo thành ở cực dương sẽ tác dụng với natri hiđroxit tạo thành nước Giaven. Do tính chất oxi hoá mạnh, nước Giaven được dùng để tẩy trắng sợi, vải, giấy, sát trùng và khử mùi các khu vực bị ô nhiễm.

Clorua vôi là muối hỗn tạp của canxi với hai gốc axit khác nhau.
So với nước Giaven, clorua vôi có giá thành rẻ hơn, dễ chuyên chở hơn nên được sử dụng rộng rãi làm chất tẩy trắng, sát trùng, khử ô nhiễm bảo vệ môi trường.
Muối clorat là muối của axit HClO3. Muối clorat quan trọng hơn cả là KClO3.
Điều chế:
3Cl2 + 6KOH ® 5KCl + KClO3 + 3H2O
Trong công nghiệp muối kali clorat được điều chế bằng cách điện phân dung dịch KCl 25% ở nhiệt độ 70 - 75oC.
Muối kali clorat tan nhiều trong nước nóng, ít tan trong nước lạnh. Vì vậy, khi làm lạnh dung dịch bão hoà, muối kali clorat dễ dàng tách ra khỏi dung dịch.
Muối kali clorat được sử dụng để điều chế oxi trong phòng thí nghiệm, sản xuất pháo hoa, thuốc nổ. Thuóc gắn ở đầu que diêm thường chứa 50% muối kali clorat.

Câu 2: Có hỗn hợp gồm NaI và NaBr. Hoà tan hỗn hợp vào nước. Cho brom dư vào dung dịch. Sau khi phản ứng thực hiện xong làm bay hơi dung dịch, làm khô sản phẩm thì thấy khối lượng của sản phẩm nhỏ hơn khối lượng hỗn hợp hai muối ban đầu là m gam.
Lại hoà tan sản phẩm vào nước và cho clo lội qua cho đến dư. Làm bay hơi dung dịch và làm khô chất còn lại; người ta thấy khối lượng chất thu được nhỏ hơn khối lượng muối phản ứng là m gam.
Xác định phần trăm về khối lượng của NaBr trong hỗn hợp đầu.
Đáp án: NaBr = 3,7%
Gọi x là số mol NaI, y là số mol NaBr trong hỗn hợp.
2NaI + Br2 = 2NaBr + I2 (khi làm khô thì iôt thăng hoa)
1mol 1mol
(150g) (103g) khối lượng giảm đi 47g so với khối lượng muối ban đầu
x mol x mol ……………………47x = m (1)
2NaBr + Cl2 = 2NaCl + Br2
1mol 1mol
(103g) (58,5g) khối lượng giảm đi 44,5g
(x + y) mol (x + y) mol……………………44,5(x + y) = m (2)
Kết hợp (1) và (2) ta có:
47x = 44,5 (x + y) → x : y = 17,8 : 1
Điều đó có nghĩa là, nếu NaI là 17,8 mol thì NaBr là 1 mol
Phần trăm về khối lượng của NaBr trong hỗn hợp:
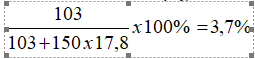
Câu 3: Gây phản ứng nổ một hỗn hợp 5,6 lít khí H2 và Cl2 (đktc) trong một bình kín, rồi cho toàn bộ sản phẩm tác dụng với dung dịch NaOH vừa đủ, cho ra dung dịch có thể tích bằng 200ml và tổng nồng độ các muối tan là 1,5M. Tính phần trăm thể tích của Cl2 và H2 trong hỗn hợp đầu (phản ứng với NaOh ở nhiệt độ thường).
Đáp án: Toàn bộ sản phẩm tác dụng hết với NaOH → không còn H2 sau phản ứng, nghĩa là hiệu suất 100%.
Vậy có hai trường hợp:
a. Cl2 và H2 phản ứng vừa đủ suy ra
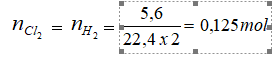
H2 + Cl2 → 2HCl
0,125 0,125 0,25 (mol)
Sản phẩm chỉ có HCl
HCl + NaOH → NaCl + H2O
0,25 0,25 (mol)
Nếu vậy, nồng độ muối trong dung dịch là nồng độ của NaCl và phải là:

b. Cl2 dư H2 hết:
Đặt trong hỗn hợp đầu
Số mol H2: a mol ; số mol Cl2: b mol
H2 + Cl2 → 2HCl
Ban đầu a b (mol)
Phản ứng a a 2a
Sau phản ứng 0 (b – a) 2a
- Sản phẩm (HCl, Cl2 dư) + NaOH:
HCl + NaOH → NaCl + H2O
2a 2a
Cl2 + NaOH → NaCl + NaClO + H2O
(b – a) (b – a) (b – a)
Ta có: a + b = 0,25 (1)
2a + (b – a) + (b – a) = 1,5 x 0,2 = 0,3 hay 2b = 0,3 (2)
Từ (1), (2) → a = 0,1; b = 0,15
Vì %V = % n →
Câu 4: Có một loại đá X chứa a% Al2O3, b% Fe2O3, phần trăm còn lại là hỗn hợp CaCO3 và MgCO3. Lấy một mẫu đá X nung ở nhiệt độ cao một thời gian thu được chất rắn Y có khối lượng bằng 82% khối lượng đá khi nung. Để hoà tan hoàn toàn 10gam chất rắn Y tiêu tốn 173ml dung dịch HCl 2M. Mặt khác nung mẫu đá X tới khối lượng không đổi (phân huỷ hoàn toàn các muối cacbonat) thu được chất rắn Z.
Lập biểu thức tính % khối lượng của Z so với khối lượng đá trước khi nung.
Áp dụng: a = 10,2%; b = 16%
Đáp án: Các phản ứng xảy ra khi nung X
CaCO3
 CaO + CO2 (1)
CaO + CO2 (1)MgCO3
 MgO + CO2 (2)
MgO + CO2 (2)Các phản ứng xảy ra khi hoà tan Y:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 (3)
CaO + 2HCl → CaCl2 + H2O (4)
MgCO3 + 2HCl → MgCl2 + H2O + CO2 (5)
MgO + 2HCl → MgCl2 + H2O (6)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (7)
Fe2O3 + 6HCl → FeCl3 + 3H2O (8)
Giả sử ban đầu có 100 gam đá X, trong đó a gam Al2O3, b gam Fe2O3, x mol CaCO3 và y mol MgCO3. Theo các phản ứng (1, 2, 3, 4, 5, 6) thì tổng số mol HCl tham gia các phản ứng (3, 4, 5, 6) cũng bằng tổng số mol HCl phản ứng với CaCO3, MgCO3 có trong nước khi nung. (vì 1 mol CaCO3 hoặc MgCO3 tạo ra 1 mol CaO hoặc MgO thì lượng HCl tiêu tốn như nhau. Mặt khác, muốn hoà tan cả 82 gam chất rắn Y cần dùng:

Câu 5:
1. Tính % lượng AgCl bị mất đi sau khi rửa 0,451g hợp chất này bằng:
a. 200ml nước cất
b. 150ml NH4Cl 0,1M. Rồi bằng 50ml nước cất
2. Dùng 200ml dd NH4NO3 để rửa kết tủa MgNH4PO4. Hãy tính nồng độ C% cua dd NH4NO3 để khi rửa kết tủa không mất quá 0,01g magiê oxit.
Dung dịch loãng NH4NO3 xem như D » 1 g/ml
Đáp án:


Câu 6: Giải thích và viết các phương trình phản ứng nếu có:
1. Tại sao axit HF tạo được muối axit còn các axit HX khác không có khả năng đó?
2. Đề nghị phương pháp điều chế KClO4 từ KClO3.
3. Tại sao Iốt không tạo ra hợp chất với clo tương tự hợp chất IF7.
4. Nguyên nhân hình thành tinh thể Cl2.8H2O, hiđrat đó có phải là hợp chất hoá học không?
5. Viết phương trình phản ứng khi clo Cl2 tác dụng với:
- Dung dịch Natri hiđroxit
- Dung dịch KI
- Dung dịch Natri thiosunfat.

Hoà tan sản phẩm vào nước. Sau đó tác 2 chất trên bằng phương pháp kết tinh phân (dựa vào độ tan khác nhau).
3. I (Z = 53) …. 5s25p5. Do năng lượng kích thích nguyên tử cần thiết để hình thành các electron không cặp đôi giảm dần từ Clo → Iôt. Đồng thời theo chiều từ Clo → Iôt bán kính nguyên tử tăng, nên số nguyên tử Flo có thể phân bố được nhiều hơn xung quanh nguyên tử có kích thước lớn.
4. Nguyên nhân là do trong tinh thể nước đá các phân tử H2O liên kết với nhau bằng liên kết hiđro, giữa các phân tử có khoảng trống nên áp suất cao Cl2 đã thâm nhập vào các khoảng trống đó tạo tinh thể hiđrat Cl2.8H2O. Do vậy lực tương tác giữa Cl2 và H2O là lực khuếch tán → lực này không đủ lớn để hình thành phân tử hợp chất hoá học → Cl2.8H2O không phải là hợp chất hoá học.
5. Phương trình phản ứng:
Cl2 + NaOH = NaCl + NaClO + H2O
Cl2 + 2KI = I2 + 2KCl
5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl
Na2S2O3 + 4Cl2 + 5H2O = 2NaHSO4 + 8HCl
Câu 7: Cân bằng phương trình phản ứng sau (viết phản ứng 2 ở dạng tổng quát):
1. Cl2 + NaOH → NaClO3 + NaCl + H2O
2. M2Ox + HNO3 → M(NO3)3 + NO + H2O
- Viết phản ứng 1 dưới dạng phương trình ion rút gọn.
- Với giá trị nào của x phản ứng 2 sẽ là phản ứng oxi hoá - khử hoặc phản ứng trao đổi?
Câu 8: Có một hỗn hợp gồm NaCl và NaBr, trong đó NaBr chiếm 10% về khối lượng. Hoà tan hỗn hợp vào nước rồi cho khí clo lội qua dung dịch cho đến dư. Làm bay hơi dung dịch cho tới khi thu được muối khan (muối không ngậm nước). Khối lượng hợp ban đầu đã thay đổi bao nhiêu %.
Đáp án:
Hỗn hợp NaCl và NaBr có 10% NaBr, tính tỉ lệ nguyên tố Br trong hỗn hợp và khối lượng Br thay bằng Cl. Tính khối lượng ban đầu còn, tính tỉ lệ thay đổi là 4,32%.
Câu 9: Hỗn hợp A gồm 3 muối NaCl, NaBr và NaI:
- 5,76 gam A tác dụng với lượng dư dung dịch brom, cô cạn thu được 5,29 gam muối khan.
- Hoà tan 5,76 gam A vào nước rồi cho một lượng khí clo sục qua dung dịch. Sau một thời gian, cô cạn thì thu được 3,955 gam muối khan, trong đó có 0,05 mol ion clorua.
a. Viết các phương trình phản ứng.
b. Tính thành phần phần trăm khối lượng mỗi muối trong A.
Đáp án:
Đặt số mol NaCl: a; NaBr: b; NaI: c
a/ Các phản ứng với brom dư:

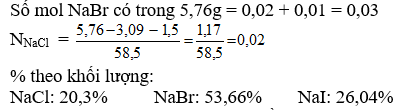
Câu 10: A, B là hai dung dịch HCl có nồng độ mol khác nhau. Nếu trộn V1 lít A với V2 lít B rồi cho tác dụng với 1,768 gam hỗn hợp kim loại gồm Fe, Al và Cu thì thấy vừa đủ để hoà tan các kim loại hoạt động có trong hỗn hợp và khi đó thu được 0,016 mol H2 đktc. Lượng Cu không tan đem oxi hoá rồi hoà tan thì cũng cần một lượng axit HCl vừa đúng như trên. Biết V1 + V2 = 0,052 lít, nồng độ mol của B lớn gấp 4 của A và V2/2 lít B hoà tan vừa hết 1/6 lượng Fe của hỗn hợp.
a. Viết các phương trình phản ứng và tính phần trăm theo khối lượng của các kim loại trong hỗn hợp.
b. Tính nồng độ mol của A và B. Giả thiết các phản ứng xảy ra hoàn toàn.
Đáp án:
a. Đặt a, b là nồng độ của HCl trong dung dịch A và B. Đặt x, y, z là số mol FE, Al, Cu.
Số mol HCl sau khi trộn = (V1a + V2b) mol
Viết các phương trình phản ứng của Fe và Al tác dụng với H+; Cu tác dụng với H+ và O2.

Câu 11:
a. Hai cốc đựng axit clohiđric đặt trên hai đĩa cân A và B. Cân ở trạng thái thăng bằng. Cho a gam CaCO3 vào cốc A và b gam M2CO3 (M là kim loại kiềm) vào cốc B. Sau khi hai muối đã phản ứng hết và tan hoàn toàn, cân trở lại vị trí thăng bằng.
- Thiết lập biểu thức tính khối lượng nguyên tử của M theo a và b.
- Xác định M khi a = 5 và b = 4,8
(1) Tính tổng khối lượng muối khan thu được biết M có hoá trị 2 trong các muối này.
(2)Xác định kim loại M nếu biết số mol tham gia phản ứng của hai kim loại bằng nhau.
Cho H = 1; C = 12; O = 16; S = 32; Cl = 35,5; Ca = 40
Đáp án:
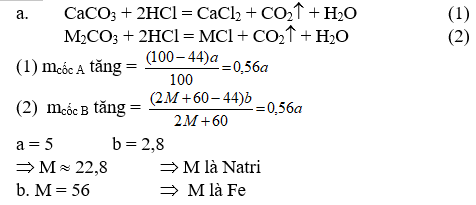
Ý kiến bạn đọc
Bạn cần đăng nhập với tư cách là Thành viên chính thức để có thể bình luận
Những tin mới hơn
Những tin cũ hơn
global video
-
-
 Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
-
 Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
-
 Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Thăm dò ý kiến
Tin xem nhiều
-
 Bài tập về thấu kính hội tụ
Bài tập về thấu kính hội tụ
-
 DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
-
 ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
-
 ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
-
 Bài tập về thấu kính phân kỳ
Bài tập về thấu kính phân kỳ
-
 Dạng bài tập về Đoạn mạch nối tiếp
Dạng bài tập về Đoạn mạch nối tiếp
-
 Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
-
 Dạng bài tập đoạn mạch song song
Dạng bài tập đoạn mạch song song
-
 CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
-
 TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
Thống kê
- Đang truy cập123
- Hôm nay31,445
- Tháng hiện tại133,969
- Tổng lượt truy cập18,992,698
Tài liệu mới
- chuyên đề Phương trình... - 18/04/2022
- Phương trình chứa ấn ở... - 28/02/2020
- Các dạng bài tập phương... - 28/02/2020
- Giáo án dạy thêm toán 6 - 27/02/2020
- Chuyên đề bồi dưỡng học... - 27/02/2020
