Chương I: Các halogen
A. Tóm tắt lý thuyết:
Nhóm halogen gồm flo (F), clo (Cl), brom (Br) và iot (I). Đặc điểm chung của nhóm là ở vị trí nhóm VIIA trong bảng tuần hoàn, có cấu hình electron lớp ngoài cùng là ns2np5. Các halogen thiếu một electron nữa là bão hòa lớp electron ngoài cùng, do đó chúng có xu hướng nhận electron, thể hiện tính oxi hóa mạnh. Trừ flo, các nguyên tử halogen khác đều có các obitan d trống, điều này giúp giải thích các số oxi hóa +1, +3, + 5, +7 của các halogen. Nguyên tố điển hình, có nhiều ứng dụng nhất của nhóm VIIA là clo.
Nhóm halogen gồm flo (F), clo (Cl), brom (Br) và iot (I). Đặc điểm chung của nhóm là ở vị trí nhóm VIIA trong bảng tuần hoàn, có cấu hình electron lớp ngoài cùng là ns2np5. Các halogen thiếu một electron nữa là bão hòa lớp electron ngoài cùng, do đó chúng có xu hướng nhận electron, thể hiện tính oxi hóa mạnh. Trừ flo, các nguyên tử halogen khác đều có các obitan d trống, điều này giúp giải thích các số oxi hóa +1, +3, + 5, +7 của các halogen. Nguyên tố điển hình, có nhiều ứng dụng nhất của nhóm VIIA là clo.

a. Tính chất vật lí Là chất khí màu vàng lục, ít tan trong nước.
b. Tính chất hoá học: Clo là một chất oxi hoá mạnh thể hiện ở các phản ứng sau:
1- Tác dụng với kim loại Kim loại mạnh: 2Na + Cl2 ® 2NaCl
Kim loại trung bình: 2Fe + 3Cl2 ® 2FeCl3
Kim loại yếu: Cu + Cl2 ® CuCl2
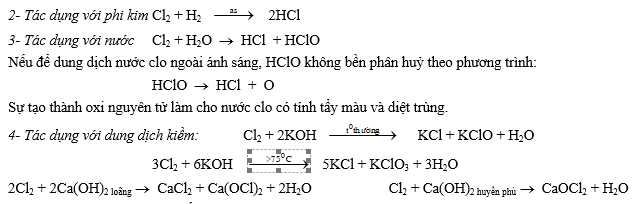
5- Tác dụng với dung dịch muối của halogen đứng sau:
Cl2 + 2NaBr ® 2NaCl + Br2 Cl2 + 2NaI ® 2NaCl + I2
6- Tác dụng với hợp chất: 2FeCl2 + Cl2 ® 2FeCl3 6FeSO4 + 3Cl2 ® 2Fe2(SO4)3 + 2FeCl3
SO2 + Cl2 + 2H2O ® H2SO4+ 2HCl H2S + 4Cl2 + 4H2O ® H2SO4+ 8HCl
c. Điều chế Nguyên tắc: Oxi hoá 2Cl- ® Cl2 bằng các chất oxi hoá mạnh, chẳng hạn như:
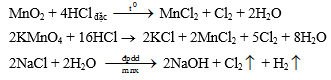
II- Axit HCl
1- Tác dụng với kim loại (đứng trước H): 2Al + 6HCl ® 2AlCl3 +3 H2 Fe + 2HCl ® FeCl2 + H2
Fe + 2HCl ® FeCl2 + H2
2- Tác dụng với bazơ: HCl + NaOH ® NaCl + H2O 2HCl + Mg(OH)2 ® MgCl2 + H2O
3- Tác dụng với oxit bazơ Al2O3 + 6HCl ® 2AlCl3 + 3H2O CuO + 2HCl ® CuCl2 + H2O
4- Tác dụng với muối (tạo kết tủa hoặc chất bay hơi) CaCO3 + 2HCl ® CaCl2 + CO2 + H2O
+ H2O
FeS + 2HCl ® FeCl2 + H2S Na2SO3 + 2HCl ® 2NaCl + SO2
Na2SO3 + 2HCl ® 2NaCl + SO2 + H2O
+ H2O
AgNO3 + HCl ® AgCl + HNO3
+ HNO3
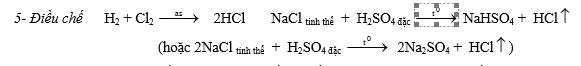
III. Nước Giaven Cl2 + 2KOH ® KCl + KClO + H2O Cl2 + 2NaOH ® NaCl + NaClO + H2O (Dung dịch KCl + KClO + H2O hoặc NaCl + NaClO+ H2O được gọi là nước Giaven)
IV. Clorua vôI - Điều chế: Cl2 + Ca(OH)2 sữa vôi ® CaOCl2 + 2H2O
(Hợp chất CaOCl2 được gọi là clorua vôi)
đề bài
1. Gây nổ hỗn hợp gồm ba khí trong bình kín. Một khí được điều chế bằng cách cho axit clohiđric có dư tác dụng với 21,45g Zn. Khí thứ hai thu được khi phân huỷ 25,5g natri nitrat, phương trình phản ứng:
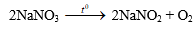
Khí thứ ba thu được do axit clohiđric đặc, có dư tác dụng với 2,61g mangan đioxit.
Tính nồng độ phần trăm (%) của chất trong dung dịch thu được sau khi gây ra nổ.
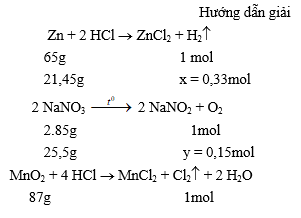
2,61g 0,03mol
Phản ứng xảy ra giữa các khí theo phương trình phản ứng :
2H2 + O2 ® 2H2O
0,3mol ơ 0,15mol đ 0,3mol
H2 + Cl2 ® 2HCl
0,03mol ơ 0,03mol đ 0,06mol
Như vậy, các khí tác dụng với nhau vừa đủ, phản ứng tạo thành 0,3mol nước hay 0,3 . 18 = 5,4 (g) nước ; 0,06mol hiđro clorua, hay 0,06 . 36,5 = 2,19 (g) HCl. Khí HCl tan trong nước tạo thành axit clohiđric
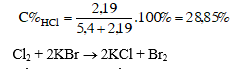
2. Khi cho 20m3 không khí có chứa khí clo đi qua một ống đựng muối KBr, khối lượng của muối đó giảm bớt 178 mg. Xác định hàm lượng của khí clo (mg/m3) trong không khí
Giải
Cl2 + 2KBr ® 2KCl + Br2
Sau khi đã phản ứng, muối KBr giảm khối lượng là vì clo đã thay thế brom. Một mol Br2 có khối lượng lớn hơn một

3. Hỗn hợp A gồm hai kim loại Mg và Zn. Dung dịch B là dung dịch HCl nồng độ a mol/lít.
Thí nghiệm 1: Cho 8,9g hỗn hợp A vào 2 lít dung dịch B, kết thúc phản ứng thu được 4,48lít H2 (đktc).
Thí nghiệm 2: Cho 8,9g hỗn hợp A vào 3 lít dung dịch B, kết thúc phản ứng cũng thu được 4,48lít H2 (đktc).
Tính a và phần trăm khối lượng mỗi kim loại trong A? Cho: Mg = 24, Zn = 65, H = 1, Cl = 35,5.

4. Hỗn hợp A gồm KClO3, Ca(ClO3)2, Ca(ClO)2, CaCl2 và KCl nặng 83,68 gam. Nhiệt phân hoàn toàn A ta thu được chất rắn B gồm CaCl2, KCl và một thể tích O2 vừa đủ oxi hoá SO2 thành SO3 để điều chế 191,1 gam dung dịch H2SO4 80%. Cho chất rắn B tác dụng với 360 ml dung dịch K2CO3 0,5M (vừa đủ) thu được kết tủa C và dung dịch D. Lượng KCl trong dung dịch D nhiều gấp 22/3 lần lượng KCl có trong A.
- Tính khối lượng kết tủa A. - Tính % khối lượng của KClO3 trong A.
Giải

5. Hoà tan 1,74g MnO2 trong 200ml axit clohiđric 2M. Tính nồng độ (mol/l) của HCl và MnCl2 trong dung dịch sau khi phản ứng kết thúc. Giả thiết khí clo thoát hoàn toàn khỏi dung dịch và thể tích của dung dịch không biến đổi.
Giải
MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O
1 mol 4 mol 1 mol
0,02mol 0,08 mol 0,03mol
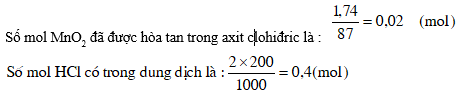
Nhìn vào phương trình phản ứng, ta thấy 1 mol MnO2 tác dụng với 4 mol HCl tạo nên 1 mol MnCl2. Vậy 0,02 mol MnO2 đã tác dụng với 0,08 mol HCl tạo nên 0,02 mol MnCl2.
Số mol HCl còn lại trong dung dịch là : 0,4 mol - 0,08mol = 0,32 mol

b. Tính chất hoá học: Clo là một chất oxi hoá mạnh thể hiện ở các phản ứng sau:
1- Tác dụng với kim loại Kim loại mạnh: 2Na + Cl2 ® 2NaCl
Kim loại trung bình: 2Fe + 3Cl2 ® 2FeCl3
Kim loại yếu: Cu + Cl2 ® CuCl2

5- Tác dụng với dung dịch muối của halogen đứng sau:
Cl2 + 2NaBr ® 2NaCl + Br2 Cl2 + 2NaI ® 2NaCl + I2
6- Tác dụng với hợp chất: 2FeCl2 + Cl2 ® 2FeCl3 6FeSO4 + 3Cl2 ® 2Fe2(SO4)3 + 2FeCl3
SO2 + Cl2 + 2H2O ® H2SO4+ 2HCl H2S + 4Cl2 + 4H2O ® H2SO4+ 8HCl
c. Điều chế Nguyên tắc: Oxi hoá 2Cl- ® Cl2 bằng các chất oxi hoá mạnh, chẳng hạn như:
II- Axit HCl
1- Tác dụng với kim loại (đứng trước H): 2Al + 6HCl ® 2AlCl3 +3 H2
 Fe + 2HCl ® FeCl2 + H2
Fe + 2HCl ® FeCl2 + H2
2- Tác dụng với bazơ: HCl + NaOH ® NaCl + H2O 2HCl + Mg(OH)2 ® MgCl2 + H2O
3- Tác dụng với oxit bazơ Al2O3 + 6HCl ® 2AlCl3 + 3H2O CuO + 2HCl ® CuCl2 + H2O
4- Tác dụng với muối (tạo kết tủa hoặc chất bay hơi) CaCO3 + 2HCl ® CaCl2 + CO2
 + H2O
+ H2OFeS + 2HCl ® FeCl2 + H2S
 Na2SO3 + 2HCl ® 2NaCl + SO2
Na2SO3 + 2HCl ® 2NaCl + SO2 + H2O
+ H2OAgNO3 + HCl ® AgCl
 + HNO3
+ HNO3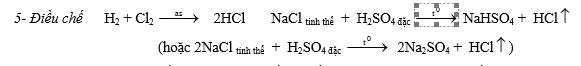
III. Nước Giaven Cl2 + 2KOH ® KCl + KClO + H2O Cl2 + 2NaOH ® NaCl + NaClO + H2O (Dung dịch KCl + KClO + H2O hoặc NaCl + NaClO+ H2O được gọi là nước Giaven)
IV. Clorua vôI - Điều chế: Cl2 + Ca(OH)2 sữa vôi ® CaOCl2 + 2H2O
(Hợp chất CaOCl2 được gọi là clorua vôi)
đề bài
1. Gây nổ hỗn hợp gồm ba khí trong bình kín. Một khí được điều chế bằng cách cho axit clohiđric có dư tác dụng với 21,45g Zn. Khí thứ hai thu được khi phân huỷ 25,5g natri nitrat, phương trình phản ứng:
Khí thứ ba thu được do axit clohiđric đặc, có dư tác dụng với 2,61g mangan đioxit.
Tính nồng độ phần trăm (%) của chất trong dung dịch thu được sau khi gây ra nổ.

2,61g 0,03mol
Phản ứng xảy ra giữa các khí theo phương trình phản ứng :
2H2 + O2 ® 2H2O
0,3mol ơ 0,15mol đ 0,3mol
H2 + Cl2 ® 2HCl
0,03mol ơ 0,03mol đ 0,06mol
Như vậy, các khí tác dụng với nhau vừa đủ, phản ứng tạo thành 0,3mol nước hay 0,3 . 18 = 5,4 (g) nước ; 0,06mol hiđro clorua, hay 0,06 . 36,5 = 2,19 (g) HCl. Khí HCl tan trong nước tạo thành axit clohiđric
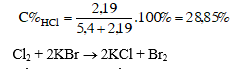
2. Khi cho 20m3 không khí có chứa khí clo đi qua một ống đựng muối KBr, khối lượng của muối đó giảm bớt 178 mg. Xác định hàm lượng của khí clo (mg/m3) trong không khí
Giải
Cl2 + 2KBr ® 2KCl + Br2
Sau khi đã phản ứng, muối KBr giảm khối lượng là vì clo đã thay thế brom. Một mol Br2 có khối lượng lớn hơn một

3. Hỗn hợp A gồm hai kim loại Mg và Zn. Dung dịch B là dung dịch HCl nồng độ a mol/lít.
Thí nghiệm 1: Cho 8,9g hỗn hợp A vào 2 lít dung dịch B, kết thúc phản ứng thu được 4,48lít H2 (đktc).
Thí nghiệm 2: Cho 8,9g hỗn hợp A vào 3 lít dung dịch B, kết thúc phản ứng cũng thu được 4,48lít H2 (đktc).
Tính a và phần trăm khối lượng mỗi kim loại trong A? Cho: Mg = 24, Zn = 65, H = 1, Cl = 35,5.

4. Hỗn hợp A gồm KClO3, Ca(ClO3)2, Ca(ClO)2, CaCl2 và KCl nặng 83,68 gam. Nhiệt phân hoàn toàn A ta thu được chất rắn B gồm CaCl2, KCl và một thể tích O2 vừa đủ oxi hoá SO2 thành SO3 để điều chế 191,1 gam dung dịch H2SO4 80%. Cho chất rắn B tác dụng với 360 ml dung dịch K2CO3 0,5M (vừa đủ) thu được kết tủa C và dung dịch D. Lượng KCl trong dung dịch D nhiều gấp 22/3 lần lượng KCl có trong A.
- Tính khối lượng kết tủa A. - Tính % khối lượng của KClO3 trong A.
Giải

5. Hoà tan 1,74g MnO2 trong 200ml axit clohiđric 2M. Tính nồng độ (mol/l) của HCl và MnCl2 trong dung dịch sau khi phản ứng kết thúc. Giả thiết khí clo thoát hoàn toàn khỏi dung dịch và thể tích của dung dịch không biến đổi.
Giải
MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O
1 mol 4 mol 1 mol
0,02mol 0,08 mol 0,03mol
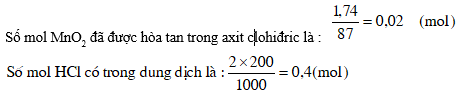
Nhìn vào phương trình phản ứng, ta thấy 1 mol MnO2 tác dụng với 4 mol HCl tạo nên 1 mol MnCl2. Vậy 0,02 mol MnO2 đã tác dụng với 0,08 mol HCl tạo nên 0,02 mol MnCl2.
Số mol HCl còn lại trong dung dịch là : 0,4 mol - 0,08mol = 0,32 mol

Ý kiến bạn đọc
Bạn cần đăng nhập với tư cách là Thành viên chính thức để có thể bình luận
Những tin mới hơn
Những tin cũ hơn
global video
-
-
 Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
-
 Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
-
 Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Thăm dò ý kiến
Tin xem nhiều
-
 Bài tập về thấu kính hội tụ
Bài tập về thấu kính hội tụ
-
 DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
-
 ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
-
 ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
-
 Bài tập về thấu kính phân kỳ
Bài tập về thấu kính phân kỳ
-
 Dạng bài tập về Đoạn mạch nối tiếp
Dạng bài tập về Đoạn mạch nối tiếp
-
 Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
-
 Dạng bài tập đoạn mạch song song
Dạng bài tập đoạn mạch song song
-
 CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
-
 TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
Thống kê
- Đang truy cập72
- Hôm nay15,182
- Tháng hiện tại500,714
- Tổng lượt truy cập18,588,898
Tài liệu mới
- chuyên đề Phương trình... - 18/04/2022
- Phương trình chứa ấn ở... - 28/02/2020
- Các dạng bài tập phương... - 28/02/2020
- Giáo án dạy thêm toán 6 - 27/02/2020
- Chuyên đề bồi dưỡng học... - 27/02/2020
