Bài tập về nguyên tử
Dạng 1: TÍNH TOÁN VỀ NGUYÊN TỬ
●Phương pháp: ghi nhớ công thức
- Khối lượng tuyệt đối của nguyên tử: mnguyên tử =M .u với M là khôi lượng tương đối của nguyên tử so với u
●Phương pháp: ghi nhớ công thức
- Khối lượng tuyệt đối của nguyên tử: mnguyên tử =M .u với M là khôi lượng tương đối của nguyên tử so với u

- Khối lượng các hạt trong nguyên tử: u= 1,6605. 10-27 kg
me= 9,1 .10-31 kg = 0,0055u
mp= mn =1,66.10-27kg =u
- Tính khối lượng riêng: D=m/V với
●Bài tập mẫu:
Ví dụ 1: cho biết 1u = 1,6605. 10-27kg, nguyên tử khối của oxi bằng 15,999. hãy tính khối lượng tuyệt đối của oxi ra kg.
Giải:
Ta có: mo= M . u= 15,999.1,6605,10-27 = 26,566.10-27 kg
Ví dụ 2: trong 1,5kg đồng có bao nhiêu gam e ? cho biết 1 mol nguyên tử đồng có khối lượng bằng 63,546 gam, một nguyên tử đồng có 29 electron.
Giải:
Trong 63,546 gam có 6,02.1023 nguyên tử đồng
Ma: cứ 1 nguyên tử đồng có 29 e
Vậy: trong 63,546 gam đồng có 29.6,02.1023 e
Suy ra: trong 1500 gam đồng có 4121.1023 e
Suy ra khối lượng e trong 1500 gam đồng là:
4121.1023 .9,1.10-31=3,75.10-4 kg

●Bài tập mẫu:
Ví dụ 1 : Tổng số proton,electron,notron của nguyên tố X là 21.hãy xác định cấu tạo nguyên tử, gọi tên và viết kí hiệu nguyên tố X.
Giải:
Ta có: p+n+e=21 <=> 2p+n=21
<=>n=21-2p (1)
Mà: p≤n≤1,52p (2)
Từ (1)(2) =>3p≤21≤3,52p.
Thay : p=5 loại
p=6 loại vì A=9+6=15,không có trong BHTTH
p=8 loại
p=7 nhận vì A=7+7=14 là Nito
vậy p=n=e=7 và 714 N.
Ví dụ 2: Một kim loại M có số khối là 54,tổng số hạt p n e trong ion M2+ là 78.kí hiệu nguyên tử M là
A. 24Cr B. 25Mn C . 26Fe D. 27Co
Giải:
Theo giả thiết : p +n = 54
2p +n =80
Dạng 4:VIẾT CẤU HÌNH ELECTRON NGUYÊN TỬ, LIÊN QUAN GIỮA CẤU HÌNH ELECTRON
VÀ TÍNH CHẤT NGUYÊN
●Phương pháp :
- Xác định số e nguyên tử
-Các e được phân bố theo thứ tự tăng dần các mức năng lượng AO, theo các nguyên lý v quy tắc phn bố electron trong nguyn tử .
-Viết cấu hình electron theo thứ tự cc phn lớp trong một lớp v theo thứ tự của cc e.
●Bi tập mẫu :
Ví dụ 1 : Viết cấu hình electron của cc ion Cu2+, N3-, Fe3+,Cl- , Al3+. Biết số thứ tự của các nguyên tố lần lượt là Cu(Z=21), N(Z=29), Fe(Z=26), Cl(Z=17), Al(Z=13).
Giải:
Cu2+ : 1s2 2s2 2p6 3s2 3 p6 3d9
N3- : 1s2 2s2 2p6
Fe3+ : 1s2 2s2 2p6 3s2 3 p6 3d5
Cl- : 1s2 2s2 2p6 3s2 3 p6
Al3+: 1s2 2s2 2p6
Ví dụ 2:Cho nguyên tử M khi mất đi một electron ta được cation M+ cĩ cấu hình electron ở lớp ngồi cng l 3p6 .
a. Viết cấu hình electron v sự phn bố electron theo Obitan của nguyn tử M
b. Cho biết số electron độc thân của nguyn tử M
Giải
Vì cation M+ được tạo thành do nguyên tử M mất một electron ở lớp vỏ ngoài cùng do đó nguyên tử M có một electron so với số electron 3p6 của M+
me= 9,1 .10-31 kg = 0,0055u
mp= mn =1,66.10-27kg =u
- Tính khối lượng riêng: D=m/V với
●Bài tập mẫu:
Ví dụ 1: cho biết 1u = 1,6605. 10-27kg, nguyên tử khối của oxi bằng 15,999. hãy tính khối lượng tuyệt đối của oxi ra kg.
Giải:
Ta có: mo= M . u= 15,999.1,6605,10-27 = 26,566.10-27 kg
Ví dụ 2: trong 1,5kg đồng có bao nhiêu gam e ? cho biết 1 mol nguyên tử đồng có khối lượng bằng 63,546 gam, một nguyên tử đồng có 29 electron.
Giải:
Trong 63,546 gam có 6,02.1023 nguyên tử đồng
Ma: cứ 1 nguyên tử đồng có 29 e
Vậy: trong 63,546 gam đồng có 29.6,02.1023 e
Suy ra: trong 1500 gam đồng có 4121.1023 e
Suy ra khối lượng e trong 1500 gam đồng là:
4121.1023 .9,1.10-31=3,75.10-4 kg

●Bài tập mẫu:
Ví dụ 1 : Tổng số proton,electron,notron của nguyên tố X là 21.hãy xác định cấu tạo nguyên tử, gọi tên và viết kí hiệu nguyên tố X.
Giải:
Ta có: p+n+e=21 <=> 2p+n=21
<=>n=21-2p (1)
Mà: p≤n≤1,52p (2)
Từ (1)(2) =>3p≤21≤3,52p.
Thay : p=5 loại
p=6 loại vì A=9+6=15,không có trong BHTTH
p=8 loại
p=7 nhận vì A=7+7=14 là Nito
vậy p=n=e=7 và 714 N.
Ví dụ 2: Một kim loại M có số khối là 54,tổng số hạt p n e trong ion M2+ là 78.kí hiệu nguyên tử M là
A. 24Cr B. 25Mn C . 26Fe D. 27Co
Giải:
Theo giả thiết : p +n = 54
2p +n =80
- trong nguyên tử M: p=e=26
- n=28 .vậy nguyên tử M là : 26Fe
- Dạng 3 : TÍNH TỈ KHỐI, TÍNH PHẦN TRĂM ĐỒNG VỊ VÀ NGUYÊN TỬ KHỐI TRUNG BÌNH
- ●Phương pháp: nghi nhớ công thức tính
- Nguyên tử khối trung bình A:

- Ví dụ 1 : trong tự nhiên Hidro có hai đồng vị 1H 99,984% và 2H 0,016% và Clo có hai đồng vị 35Cl 75,77% và 37Cl 24,23%
- tính nguyên tử khối trung bình của mổi nguyên tố
- có thề tạo nên được bao nhiêu phân tử HCl từ hai nguyên tử của hai nguyên tố đó.
- Tính phân tử khối của mổi loại hợp chất nói trên
- Giải :

- Ví dụ 2 :
Cho 4,12g dung dịch muối NaX tác dụng vừa đủ với dung dịch AgNO3 thu được 7,52g kết tủa.Tính nguyn tử khối X v gọi tn .Nguyên tử X có hai đồng vị biết đồng vị thứ hai có số nơtron nhiều hơn đồng vị thứ nhất là 2 và phầm trăm của 2 đồng vị bằng nhau ,tính số khối của mỗi đồng vị ?
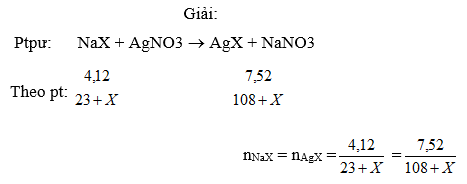

Dạng 4:VIẾT CẤU HÌNH ELECTRON NGUYÊN TỬ, LIÊN QUAN GIỮA CẤU HÌNH ELECTRON
VÀ TÍNH CHẤT NGUYÊN
●Phương pháp :
- Xác định số e nguyên tử
-Các e được phân bố theo thứ tự tăng dần các mức năng lượng AO, theo các nguyên lý v quy tắc phn bố electron trong nguyn tử .
-Viết cấu hình electron theo thứ tự cc phn lớp trong một lớp v theo thứ tự của cc e.
●Bi tập mẫu :
Ví dụ 1 : Viết cấu hình electron của cc ion Cu2+, N3-, Fe3+,Cl- , Al3+. Biết số thứ tự của các nguyên tố lần lượt là Cu(Z=21), N(Z=29), Fe(Z=26), Cl(Z=17), Al(Z=13).
Giải:
Cu2+ : 1s2 2s2 2p6 3s2 3 p6 3d9
N3- : 1s2 2s2 2p6
Fe3+ : 1s2 2s2 2p6 3s2 3 p6 3d5
Cl- : 1s2 2s2 2p6 3s2 3 p6
Al3+: 1s2 2s2 2p6
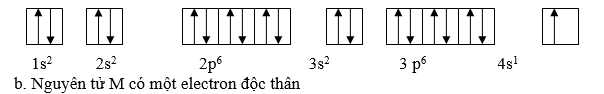
Ví dụ 2:Cho nguyên tử M khi mất đi một electron ta được cation M+ cĩ cấu hình electron ở lớp ngồi cng l 3p6 .
a. Viết cấu hình electron v sự phn bố electron theo Obitan của nguyn tử M
b. Cho biết số electron độc thân của nguyn tử M
Giải
Vì cation M+ được tạo thành do nguyên tử M mất một electron ở lớp vỏ ngoài cùng do đó nguyên tử M có một electron so với số electron 3p6 của M+
- Vậy cấu hình e v sự phn bố e vo AO :

Ý kiến bạn đọc
Bạn cần đăng nhập với tư cách là Thành viên chính thức để có thể bình luận
Những tin mới hơn
global video
-
-
 Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
-
 Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
-
 Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Thăm dò ý kiến
Tin xem nhiều
-
 Bài tập về thấu kính hội tụ
Bài tập về thấu kính hội tụ
-
 DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
-
 ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
-
 ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
-
 Bài tập về thấu kính phân kỳ
Bài tập về thấu kính phân kỳ
-
 Dạng bài tập về Đoạn mạch nối tiếp
Dạng bài tập về Đoạn mạch nối tiếp
-
 Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
-
 Dạng bài tập đoạn mạch song song
Dạng bài tập đoạn mạch song song
-
 CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
-
 TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
Thống kê
- Đang truy cập152
- Hôm nay29,406
- Tháng hiện tại131,930
- Tổng lượt truy cập18,990,659
Tài liệu mới
- chuyên đề Phương trình... - 18/04/2022
- Phương trình chứa ấn ở... - 28/02/2020
- Các dạng bài tập phương... - 28/02/2020
- Giáo án dạy thêm toán 6 - 27/02/2020
- Chuyên đề bồi dưỡng học... - 27/02/2020
