Nitơ - Photpho
Nitơ và photpho thuộc nhóm VA của bảng tuần hoàn. Cấu hình electron lớp ngoài cùng của chúng là ns2np3. Mặc dù nitơ có tính chất phi kim mạnh hơn photpho, tuy nhiên, đơn chất photpho hoạt động hóa học với oxi mạnh hơn nitơ. Tính chất kém hoạt động hóa học của nitơ được lí giải bởi liên kết ba bền vững giữa hai nguyên tử nitơ: . Nitơ chiếm khoảng 78% thể tích không khí, không độc, nhưng không duy trì sự sống. Nguyên tố N có vai trò rất quan trọng trong cuộc sống, là thành phần hóa học không thể thiếu được của các chất protit.




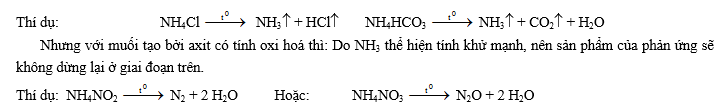
IV- Axit nitric: 1- Tính axit mạnh - Tác dụng với hidroxit (tan và không tan) Muối + H2O
HNO3 + NaOH NaNO3 + H2O 2HNO3 + Mg(OH)2 Mg(NO3)2 + 2H2O
- Tác dụng với oxit bazơ Muối + H2O Fe2O3 + 6 HNO3 2 Fe(NO3)3 + 3 H2O
CuO + 2 HNO3 Cu(NO3)2 + H2O
2- TÝnh oxi ho¸ m¹nh:
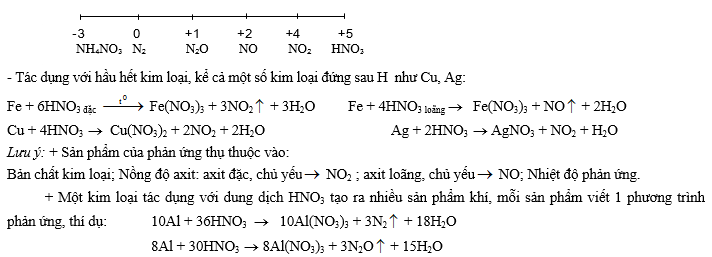
+ Các kim loại mạnh có thể khử HNO3 thành NH3 và sau đó NH3 + HNO3 ® NH4NO3, có nghĩa là trong dung dịch tồn tại NH4+ và NO3-. Chẳng hạn như: 4Mg + 10HNO3 ® 4Mg(NO3)2 + NH4NO3 + 3H2O
+ Các kim loại Al, Fe bị thụ động trong dung dịch HNO3 đặc nguội!
+ Dung dịch chứa muối nitrat (KNO3) trong môi trường axit cũng có tính chất tương tự như dung dịch HNO3, vì trong dung dịch tồn tại H+ và NO3-.
Cách giải:
Viết các phương trình điện li của muối nitrat và axit. Viết phương trình dạng ion: M + H+ + NO3-
 sản phẩm
sản phẩm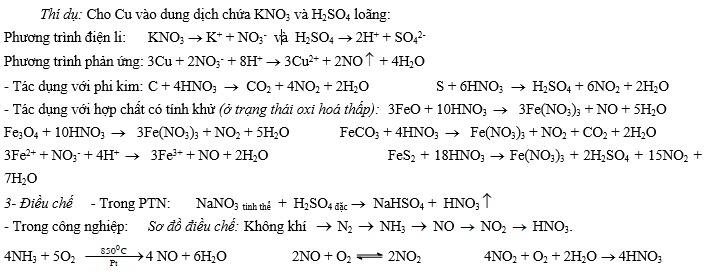
V- Muối nitrat 1- Tính tan: Tất cả các muối nitrat đều tan trong nước.
2- Phản ứng nhiệt phân (thể hiện tính kém bền nhiệt):
- Muối nitrat của kim loại hoạt động mạnh (thường là các kim loại từ Mg trở về trước trong dãy hoạt động hoá học) bị phân huỷ bởi nhiệt tao ra muối nitrit và oxi:
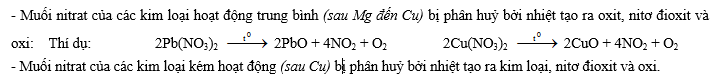
1. Cho 1,5 lít NH3 (đo ở đktc) đi qua ống đựng 16g CuO nung nóng, thu được một chất rắn X.
1. Viết phương trình phản ứng giữa NH3 và CuO, biết rằng trong phản ứng oxi hoá của nitơ tăng lên bằng 0.
2. Tính khối lượng CuO đã bị khử. 3. Tính thể tích dung dịch HCl 2M đủ để tác dụng với X.
Giải
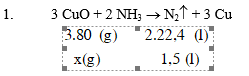
 2
22. Dẫn 1,344 lít NH3 vào bình có chứa 0,672 lít Cl2 (thể tích các khí được đo ở đktc)
1. Tính thành phần % theo thể tích của hỗn hợp khí sau phản ứng.
2. Tính khối lượng của muối NH4Cl được tạo ra.
Giải

Hỗn hợp A gồm ba khí NH3, N2 và H2. Dẫn A vào bình có nhiệt độ cao. Sau phản ứng phân huỷ NH3 (coi như hoàn toàn) thu được hỗn hợp B có thể tích tăng 25% so với A. Dẫn B đi qua ống đựng CuO nung nóng sau đó loại nước thì chỉ còn lại một chất khí có thể tích giảm 75% so với B.
Tính thành phần % theo thể tích của các khí trong hỗn hợp A.
Giải
Gọi x, y và z là thành phần % theo thể tích của ba khí NH3, H2 và N2 trong hỗn hợp A. Ta có:
x + y + z = 1 (1)
Phương trình phản ứng phân huỷ NH3: 2 NH3 ® N2 + 3 H2

Bài 3: Dung dịch A chứa hai axit HCl và HNO3 có nồng độ tương ứng là a mol/l và b mol/l.
1. Để trung hoà 20 ml dung dịch A cần dùng 300 ml dung dịch NaOH 0,1M. Mặt khác lấy 20 ml dung dịch A cho tác dụng với AgNO3 dư thấy tạo thành 2,87 gam kết tủa. Tính các giá trị của a và b.
2. Thêm từ từ Mg kim loại vào 100 ml dung dịch A cho tới khi khí ngừng thoát ra, thu được dung dịch B (thể tích vẫn 100 ml) chỉ chứa các muối của Mg và 0,963 lít hỗn hợp D gồm ba khí không màu cân nặng 0,772 gam. Trộn khí D với 1 lít O2, sau khi phản ứng hoàn toàn, cho khí còn lại đi từ từ qua dung dịch NaOH dư thì thể tích hỗn hợp khí còn lại 1,291 lít.
a. Hỏi hỗn hợp khí D gồm các khí gì ? Biết rằng trong khí D có hai khí chiếm % thể tích như nhau, các thể tích khí đo ở đktc.
b. Viết phương trình phản ứng hòa tan Mg dưới dạng ion.
c. Tính nồng độ các ion trong dung dịch B và tính khối lượng Mg đã bị tan.
Giải
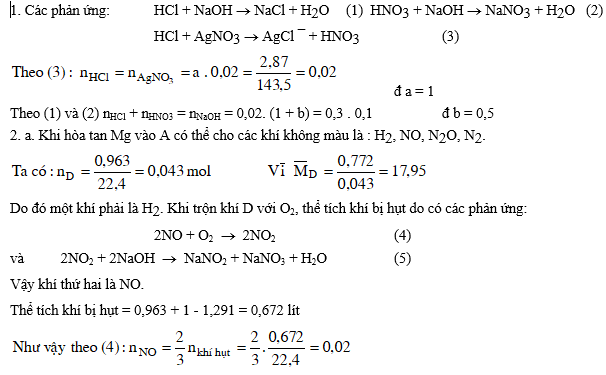

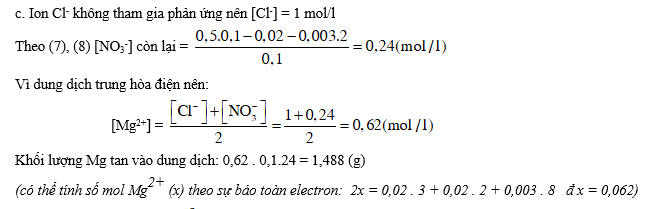
Ý kiến bạn đọc
Bạn cần đăng nhập với tư cách là Thành viên chính thức để có thể bình luận
Những tin mới hơn
Những tin cũ hơn
global video
-
-
 Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
-
 Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
-
 Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Thăm dò ý kiến
Tin xem nhiều
-
 Bài tập về thấu kính hội tụ
Bài tập về thấu kính hội tụ
-
 DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
-
 ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
-
 ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
-
 Bài tập về thấu kính phân kỳ
Bài tập về thấu kính phân kỳ
-
 Dạng bài tập về Đoạn mạch nối tiếp
Dạng bài tập về Đoạn mạch nối tiếp
-
 Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
-
 Dạng bài tập đoạn mạch song song
Dạng bài tập đoạn mạch song song
-
 CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
-
 TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
Thống kê
- Đang truy cập154
- Hôm nay46,123
- Tháng hiện tại424,656
- Tổng lượt truy cập18,512,840
Tài liệu mới
- chuyên đề Phương trình... - 18/04/2022
- Phương trình chứa ấn ở... - 28/02/2020
- Các dạng bài tập phương... - 28/02/2020
- Giáo án dạy thêm toán 6 - 27/02/2020
- Chuyên đề bồi dưỡng học... - 27/02/2020
