Oxi – Lưu huỳnh
A. Tóm Tắt lý thuyết:
Nhóm VIA gồm oxi (O), lưu huỳnh (S), selen (Se) và telu (Te). Cấu hình electron lớp ngoài cùng là ns2np4, thiếu hai electron nữa là bão hòa. Oxi và lưu huỳnh đều thể hiện tính oxi hóa mạnh, tính oxi hóa giảm dần từ oxi đến telu. Trong nhóm VIA hai nguyên tố oxi và lưu huỳnh có nhiều ứng dụng nhất trong công nghiệp và đời sống con người.
Nhóm VIA gồm oxi (O), lưu huỳnh (S), selen (Se) và telu (Te). Cấu hình electron lớp ngoài cùng là ns2np4, thiếu hai electron nữa là bão hòa. Oxi và lưu huỳnh đều thể hiện tính oxi hóa mạnh, tính oxi hóa giảm dần từ oxi đến telu. Trong nhóm VIA hai nguyên tố oxi và lưu huỳnh có nhiều ứng dụng nhất trong công nghiệp và đời sống con người.

I- Oxi – ozon:
1- Tác dụng với kim loại oxit
oxit
2Mg + O2 ® 2MgO
3Fe + 2O2 không khí Fe3O4
Fe3O4
2Cu + O2 ® 2CuO
2- Tác dụng với phi kim oxit
oxit
- Tác dụng với hidro:
2H2 + O2 ® 2H2O
- Tác dụng với cacbon:
C + O2 ® CO2
2C + O2 ® 2CO
- Tác dụng với lưu huỳnh:
S + O2 ® SO2
3- Tác dụng với hợp chất:
2H2S + 3O2 ® 2SO2 + 2H2O
2CO + O2 ® 2CO2
4- Điều chế oxi trong PTN:
Nhiệt phân các hợp chất giàu oxi và kém bền nhiệt
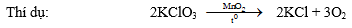
5. Ozon: Tính oxihoâ mạnh
- Tác dụng với dung dịch KI:
O3 + 2KI + H2O ® O2 + 2KOH + I2
I2 tạo thành làm xanh hồ tinh bột, phản ứng trên dùng nhận biết O3.
II- Lưu huỳnh và hợp chất:
1- Tác dụng với kim loại ® muối sunfua
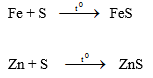
Đối với riêng thủy ngân, phản ứng có thể xảy ra ngay ở nhiệt độ phòng: Hg + S ® HgS.
Vì vậy, người ta có thể dùng bột lưu huỳnh để xử lý thủy ngân rơi vãi.
2- Tác dụng với phi kim
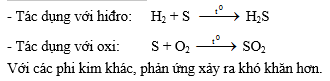
III. Hiđrosunfua:
1- Tính axit yếu:
- Tác dụng với dung dịch kiềm:
H2S + 2NaOH ® Na2S + 2H2O
H2S + NaOH ® NaHS + H2O
- Tác dụng với dung dịch muối (phản ứng nhận biết khí H2S)
H2S + Pb(NO3)2 ® PbS đen + 2HNO3
đen + 2HNO3
H2S + Cu(NO3)2 ® CuS đen + 2HNO3
đen + 2HNO3
2- Tính khử mạnh
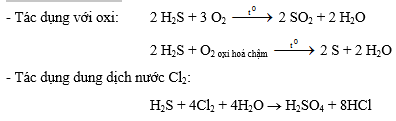
3- Điều chế
FeS + 2HCl ® FeCl2 + H2S
ZnS + H2SO4 loãng ® ZnSO4 + H2S
IV- Lưu huỳnh đioxit (khí sunfurơ)
1- Tính oxit axit
- Tác dụng với nước axit sunfurơ:
axit sunfurơ:
SO2 + H2O ® H2SO3
- Tác dụng với dung dịch bazơ Muối + H2O:
Muối + H2O:
SO2 + 2NaOH ® Na2SO3 + H2O
SO2 + NaOH ® NaHSO3



V. Lưu huỳnh trioxit:
1- Tính oxit axit:
- Tác dụng với nước axit sunfuric:
axit sunfuric:
SO2 + H2O ® H2SO4
- Tác dụng với dung dịch bazơ Muối + H2O:
Muối + H2O:
SO3 + 2NaOH ® Na2SO4 + H2O
SO3 + NaOH ® NaHSO4
- Tác dụng với oxit bazơ tan muối sunfat
muối sunfat
Na2O + SO3 ® Na2SO4
BaO + SO3 ® BaSO4
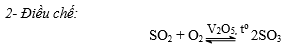
VI. Axit Sunfuric:
a- Dung dịch H2SO4 loãng (thể hiện tính axit mạnh)
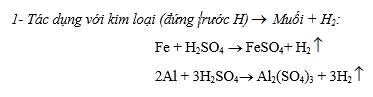
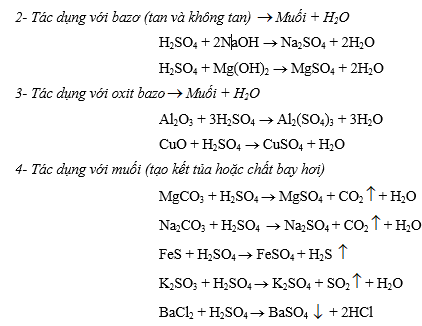
b- Dung dịch H2SO4 đặc:
1- Tính axit mạnh
1- Tính axit mạnh
- Tác dụng với hidroxit (tan và không tan) Muối + H2O
Muối + H2O
H2SO4 đặc + NaOH ® Na2SO4 + H2O
H2SO4 đặc + Mg(OH)2 ® MgSO4 + H2O
- Tác dụng với oxit bazơ Muối + H2O
Muối + H2O
Al2O3 + 3H2SO4 đặc ® Al2(SO4)3 + 3H2O
CuO + H2SO4 đặc ® CuSO4 + H2O
- Đẩy các axit dễ bay hơi ra khỏi muối

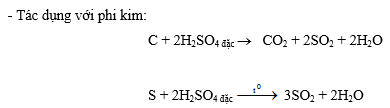
- Tác dụng với hợp chất có tính khử (ở trạng thái oxi hoá thấp)
2FeO + 4H2SO4 đặc ® Fe2(SO4)3 + SO2 + 4H2O
2FeCO3 + 4H2SO4 đặc ® Fe2(SO4)3 + SO2 + 2CO2 + 4H2O
2Fe3O4 + 10H2SO4 đặc ® 3Fe2(SO4)3 + SO2 + 10H2O
2FeSO4 + 2H2SO4 đặc ® Fe2(SO4)3 + SO2 + 2H2O
c- Điều chế H2SO4
Sơ đồ điều chế:
Quặng prit sắt FeS2 hoặc S SO2
SO2  SO3
SO3  H2SO4.
H2SO4.
d. Nhận biết: Gốc SO42- được nhận biết bằng ion Ba2+, vì tạo kết tủa trắng BaSO4 không tan trong các axit HNO3, HCl.
1. Từ 800 tấn quặng pirit sắt (FeS2) chứa 25% tạp chất không cháy, có thể sản xuất được bao nhiêu m3 dung dịch H2SO4 93% (d = 1,83) ? Giả thiết tỉ lệ hao hụt là 5%.
Giải
Phản ứng đốt cháy pirit sắt: 4 FeS2 + 11 O2 ® 2 Fe2O3 + 8 SO2
4 mol (4.120g) 8 mol
Các phản ứng chuyển SO2 thành H2SO4: 2 SO2 + O2 ® 2 SO3 SO3 + H2O ® H2SO4
Lượng FeS có trong 800 tấn quặng: 800 - (800 ´ 0,25) = 600 (tấn)

2. Oleum là gì ? Có hiện tượng gì xẩy ra khi pha loãng oleum ? Công thức của oleum là H2SO4.nSO3. Hãy viết công thức của axit có trong oleum ứng với giá trị n = 1.
Giải
a) Oleum là sản phẩm của phản ứng khi cho SO3 tan trong H2SO4 100%:
H2SO4 + nSO3 đ H2SO4 . nSO3.
Khi hoà tan oleum trong nước có hiện tượng phát nhiệt mạnh.
b) H2SO4 . nSO3 khi n = 1 có axit H2S2O7 .
3. Làm thế nào để nhận biết từng khí H2, H2S, CO2, CO trong hỗn hợp của chúng bằng phương pháp hoá học
Giải
Cho hỗn hợp khí sục từ từ qua dung dịch Pb(NO3)2 hoặc Cu(NO3)2 dư: H2S + Pb(NO3)2 ® PbS ¯ + HNO3
hỗn hợp khí còn lại cho qua nước vôi trong dư: CO2 + Ca(OH)2 ® CaCO3¯ + H2O
Khí còn lại (gồm H2, CO và có lẫn hơi H2O) cho qua H2SO4 đặc (hoặc P2O5) để loại hết hơi H2O. Đốt cháy hỗn hợp khí H2 và CO, làm lạnh để hơi nước ngưng tụ và lại cho CO2 tạo thành qua nước vôi trong.
2CO + O2 ® 2CO2 2H2 + O2 ® 2H2O
4. Tính lượng FeS2 cần dùng để điều chế một lượng SO3 đủ để tan vào 100g H2SO4 91% thành oleum chứa 12,5% SO3. Giả thiết các phản ứng được thực hiện hoàn toàn.
Giải
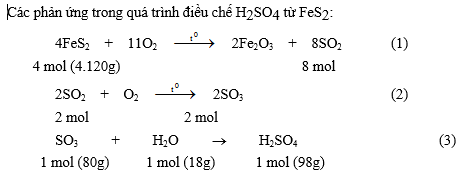
Trong 100g H2SO4 91% có 91g H2SO4 và (100 - 91)g H2O, tức là 0,5 mol H2O. Để chuyển 100g H2SO4 91% thành H2SO4 100% cần dùng 0,5 mol SO3, tức là 80 ´ 0,5 = 40g SO3 và lượng H2SO4 100% được tạo thành là 100 + 40 = 140g
Oleum là dung dịch SO3 trong axit sunfuric khan (100%). Trong oleum 12,5% có 12,5% SO3 và 87,5% H2SO4. Vậy lượng SO3 cần dùng để hoà tan vào 140g H2SO4 thành oleum 12,5% là:

5. Cho ba khí A', B', C'. Đốt cháy 1V khí A' tạo ra 1V khí B' và 2V khí C'. Phân tử A' không chứa oxi. Khí C' là sản phẩm khi đun nóng lưu huỳnh với H2SO4 đặc. Khí B' là oxit trong đó khối lượng oxi gấp 2,67 lần khối lượng của nguyên tố tạo oxit.
Viết các phương trình phản ứng khi :
- Đốt cháy hỗn hợp ba khí trên trong không khí.
- Đốt cháy hoàn toàn A' và cho sản phẩm qua dung dịch NaOH, H2SO4 đặc nóng, HNO3 đặc nóng.
- Cho B', C' từng khí qua dung dịch Na2CO3 (biết rằng axit tương ứng của SO2 mạnh hơn axit tương ứng của CO2).
Giải
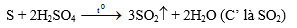
Đặt B' là oxit có dạng X2Om trong đó 16m = 2,67 . 2x đ x = 3m . X2Om là chất khí nên nó là oxit phi kim.
Ta có: 16m = 2,67 . 2x x = 3m
Khi m = 1,2 ....8 thì x = 3,6...24, trong đó chỉ có giá trị m = 4, x = 12 là phù hợp với khối lợng nguyên tử của C. Vậy B' là CO2 .
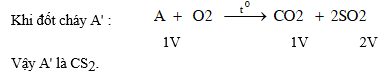
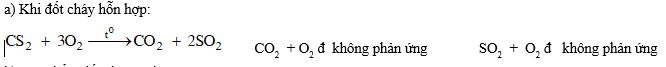
b) Sản phẩm đốt cháy A' là CO2 và SO2.
Với NaOH: CO2 + NaOH ® NaHCO3 CO2 + 2NaOH ® Na2CO3 + H2O
SO2 + NaOH ® NaHSO3 SO2 + 2NaOH ® Na2SO3 + H2O
Với H2SO4 đặc nóng: CO2 + H2SO4 đ không phản ứng. SO2 + H2SO4 đ không phản ứng.
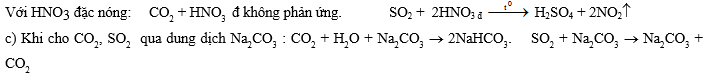
6. Hai bình kín A, B đều có dung tích không đổi 9,96 lít chứa không khí (21% oxi và 79% nitơ về thể tích) ở 27,30C và 752,4 mmHg. Cho vào cả 2 bình những lượng như nhau hỗn hợp ZnS và FeS2. Trong bình B còn thêm một ít bột lưu huỳnh (không dư). Sau khi nung bình để đốt cháy hết hỗn hợp sunfua và lưu huỳnh, đưa nhiệt độ bình về 136,50C, lúc đó trong bình A áp suất là pA và oxi chiếm 3,68% thể tích, trong bình B áp suất là pB và nitơ chiếm 83,16% thể tích.
1. Tính % thể tích các khí trong bình A.
2. Nếu lượng lưu huỳnh trong bình B thay đổi thì % thể tích các khí trong bình B thay đổi như thế nào ?
3. áp suất pA và pB.
4. Tính khối lượng hỗn hợp ZnS và FeS2 đã cho vào trong mỗi bình.Cho: O = 16, S = 32, Zn = 65, Fe = 56.
Giải
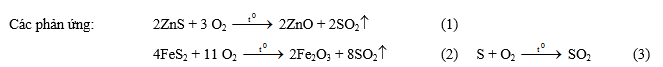
1. Theo (3) cứ 1mol O2 (k) mất đi lại sinh ra 1mol SO2 (k), nghĩa là tổng số mol khí trong hai bình như nhau, do đó %V của N2 trong 2 bình như nhau = 83,16% và % SO2 = 100% - 83,16% - 3,68% = 13,16%.
2. Do tổng số mol khí không đổi, nên % N2 luôn bằng 83,16%, còn tuỳ thuộc vào lượng S mà %O2 hoặc bằng trong bình A (nếu không có S) hoặc hết (nếu nhiều S), tức 0% ≤ %O2 ≤ 3,68%, còn % SO2 thì hoặc bằng trong bình A (nếu không có S) hoặc thêm SO2 do đốt S; tức là: 13,16% ≤ % SO2 ≤ 13,16 + 3,68 = 16,84%.
3. Thể tích và nhiệt độ như nhau, tổng số mol bằng nhau, nên PA = PB.
Gọi tổng số mol không khí ban đầu là n0, có:
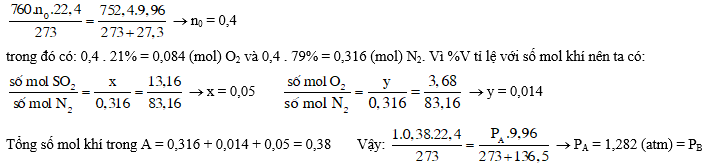
Số mol O2 tham gia phản ứng (1) và (2) = 0,084 – 0,014 = 0,07.
Gọi số mol ZnS và FeS2 lần lượt là: a và b, ta có:

1- Tác dụng với kim loại
 oxit
oxit2Mg + O2 ® 2MgO
3Fe + 2O2 không khí
 Fe3O4
Fe3O42Cu + O2 ® 2CuO
2- Tác dụng với phi kim
 oxit
oxit- Tác dụng với hidro:
2H2 + O2 ® 2H2O
- Tác dụng với cacbon:
C + O2 ® CO2
2C + O2 ® 2CO
- Tác dụng với lưu huỳnh:
S + O2 ® SO2
3- Tác dụng với hợp chất:
2H2S + 3O2 ® 2SO2 + 2H2O
2CO + O2 ® 2CO2
4- Điều chế oxi trong PTN:
Nhiệt phân các hợp chất giàu oxi và kém bền nhiệt
5. Ozon: Tính oxihoâ mạnh
- Tác dụng với dung dịch KI:
O3 + 2KI + H2O ® O2 + 2KOH + I2
I2 tạo thành làm xanh hồ tinh bột, phản ứng trên dùng nhận biết O3.
II- Lưu huỳnh và hợp chất:
1- Tác dụng với kim loại ® muối sunfua
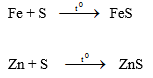
Đối với riêng thủy ngân, phản ứng có thể xảy ra ngay ở nhiệt độ phòng: Hg + S ® HgS.
Vì vậy, người ta có thể dùng bột lưu huỳnh để xử lý thủy ngân rơi vãi.
2- Tác dụng với phi kim
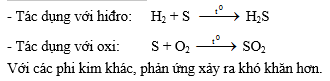
III. Hiđrosunfua:
1- Tính axit yếu:
- Tác dụng với dung dịch kiềm:
H2S + 2NaOH ® Na2S + 2H2O
H2S + NaOH ® NaHS + H2O
- Tác dụng với dung dịch muối (phản ứng nhận biết khí H2S)
H2S + Pb(NO3)2 ® PbS
 đen + 2HNO3
đen + 2HNO3H2S + Cu(NO3)2 ® CuS
 đen + 2HNO3
đen + 2HNO32- Tính khử mạnh
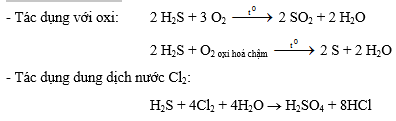
3- Điều chế
FeS + 2HCl ® FeCl2 + H2S

ZnS + H2SO4 loãng ® ZnSO4 + H2S

IV- Lưu huỳnh đioxit (khí sunfurơ)
1- Tính oxit axit
- Tác dụng với nước
 axit sunfurơ:
axit sunfurơ:SO2 + H2O ® H2SO3
- Tác dụng với dung dịch bazơ
 Muối + H2O:
Muối + H2O:SO2 + 2NaOH ® Na2SO3 + H2O
SO2 + NaOH ® NaHSO3



V. Lưu huỳnh trioxit:
1- Tính oxit axit:
- Tác dụng với nước
 axit sunfuric:
axit sunfuric:SO2 + H2O ® H2SO4
- Tác dụng với dung dịch bazơ
 Muối + H2O:
Muối + H2O:SO3 + 2NaOH ® Na2SO4 + H2O
SO3 + NaOH ® NaHSO4
- Tác dụng với oxit bazơ tan
 muối sunfat
muối sunfatNa2O + SO3 ® Na2SO4
BaO + SO3 ® BaSO4
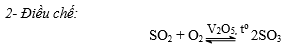
VI. Axit Sunfuric:
a- Dung dịch H2SO4 loãng (thể hiện tính axit mạnh)
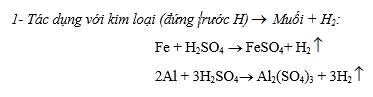
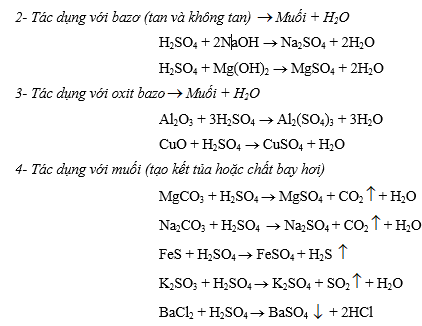
b- Dung dịch H2SO4 đặc:
1- Tính axit mạnh
1- Tính axit mạnh
- Tác dụng với hidroxit (tan và không tan)
 Muối + H2O
Muối + H2OH2SO4 đặc + NaOH ® Na2SO4 + H2O
H2SO4 đặc + Mg(OH)2 ® MgSO4 + H2O
- Tác dụng với oxit bazơ
 Muối + H2O
Muối + H2OAl2O3 + 3H2SO4 đặc ® Al2(SO4)3 + 3H2O
CuO + H2SO4 đặc ® CuSO4 + H2O
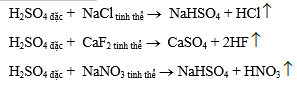
- Đẩy các axit dễ bay hơi ra khỏi muối


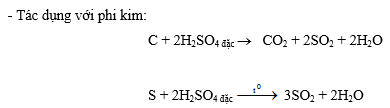
- Tác dụng với hợp chất có tính khử (ở trạng thái oxi hoá thấp)
2FeO + 4H2SO4 đặc ® Fe2(SO4)3 + SO2 + 4H2O
2FeCO3 + 4H2SO4 đặc ® Fe2(SO4)3 + SO2 + 2CO2 + 4H2O
2Fe3O4 + 10H2SO4 đặc ® 3Fe2(SO4)3 + SO2 + 10H2O
2FeSO4 + 2H2SO4 đặc ® Fe2(SO4)3 + SO2 + 2H2O
c- Điều chế H2SO4
Sơ đồ điều chế:
Quặng prit sắt FeS2 hoặc S
 SO2
SO2  SO3
SO3  H2SO4.
H2SO4.d. Nhận biết: Gốc SO42- được nhận biết bằng ion Ba2+, vì tạo kết tủa trắng BaSO4 không tan trong các axit HNO3, HCl.
1. Từ 800 tấn quặng pirit sắt (FeS2) chứa 25% tạp chất không cháy, có thể sản xuất được bao nhiêu m3 dung dịch H2SO4 93% (d = 1,83) ? Giả thiết tỉ lệ hao hụt là 5%.
Giải
Phản ứng đốt cháy pirit sắt: 4 FeS2 + 11 O2 ® 2 Fe2O3 + 8 SO2
4 mol (4.120g) 8 mol
Các phản ứng chuyển SO2 thành H2SO4: 2 SO2 + O2 ® 2 SO3 SO3 + H2O ® H2SO4
Lượng FeS có trong 800 tấn quặng: 800 - (800 ´ 0,25) = 600 (tấn)

2. Oleum là gì ? Có hiện tượng gì xẩy ra khi pha loãng oleum ? Công thức của oleum là H2SO4.nSO3. Hãy viết công thức của axit có trong oleum ứng với giá trị n = 1.
Giải
a) Oleum là sản phẩm của phản ứng khi cho SO3 tan trong H2SO4 100%:
H2SO4 + nSO3 đ H2SO4 . nSO3.
Khi hoà tan oleum trong nước có hiện tượng phát nhiệt mạnh.
b) H2SO4 . nSO3 khi n = 1 có axit H2S2O7 .
3. Làm thế nào để nhận biết từng khí H2, H2S, CO2, CO trong hỗn hợp của chúng bằng phương pháp hoá học
Giải
Cho hỗn hợp khí sục từ từ qua dung dịch Pb(NO3)2 hoặc Cu(NO3)2 dư: H2S + Pb(NO3)2 ® PbS ¯ + HNO3
hỗn hợp khí còn lại cho qua nước vôi trong dư: CO2 + Ca(OH)2 ® CaCO3¯ + H2O
Khí còn lại (gồm H2, CO và có lẫn hơi H2O) cho qua H2SO4 đặc (hoặc P2O5) để loại hết hơi H2O. Đốt cháy hỗn hợp khí H2 và CO, làm lạnh để hơi nước ngưng tụ và lại cho CO2 tạo thành qua nước vôi trong.
2CO + O2 ® 2CO2 2H2 + O2 ® 2H2O
4. Tính lượng FeS2 cần dùng để điều chế một lượng SO3 đủ để tan vào 100g H2SO4 91% thành oleum chứa 12,5% SO3. Giả thiết các phản ứng được thực hiện hoàn toàn.
Giải

Trong 100g H2SO4 91% có 91g H2SO4 và (100 - 91)g H2O, tức là 0,5 mol H2O. Để chuyển 100g H2SO4 91% thành H2SO4 100% cần dùng 0,5 mol SO3, tức là 80 ´ 0,5 = 40g SO3 và lượng H2SO4 100% được tạo thành là 100 + 40 = 140g
Oleum là dung dịch SO3 trong axit sunfuric khan (100%). Trong oleum 12,5% có 12,5% SO3 và 87,5% H2SO4. Vậy lượng SO3 cần dùng để hoà tan vào 140g H2SO4 thành oleum 12,5% là:

5. Cho ba khí A', B', C'. Đốt cháy 1V khí A' tạo ra 1V khí B' và 2V khí C'. Phân tử A' không chứa oxi. Khí C' là sản phẩm khi đun nóng lưu huỳnh với H2SO4 đặc. Khí B' là oxit trong đó khối lượng oxi gấp 2,67 lần khối lượng của nguyên tố tạo oxit.
Viết các phương trình phản ứng khi :
- Đốt cháy hỗn hợp ba khí trên trong không khí.
- Đốt cháy hoàn toàn A' và cho sản phẩm qua dung dịch NaOH, H2SO4 đặc nóng, HNO3 đặc nóng.
- Cho B', C' từng khí qua dung dịch Na2CO3 (biết rằng axit tương ứng của SO2 mạnh hơn axit tương ứng của CO2).
Giải
Đặt B' là oxit có dạng X2Om trong đó 16m = 2,67 . 2x đ x = 3m . X2Om là chất khí nên nó là oxit phi kim.
Ta có: 16m = 2,67 . 2x x = 3m
Khi m = 1,2 ....8 thì x = 3,6...24, trong đó chỉ có giá trị m = 4, x = 12 là phù hợp với khối lợng nguyên tử của C. Vậy B' là CO2 .
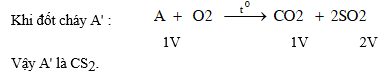
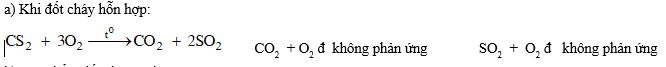
b) Sản phẩm đốt cháy A' là CO2 và SO2.
Với NaOH: CO2 + NaOH ® NaHCO3 CO2 + 2NaOH ® Na2CO3 + H2O
SO2 + NaOH ® NaHSO3 SO2 + 2NaOH ® Na2SO3 + H2O
Với H2SO4 đặc nóng: CO2 + H2SO4 đ không phản ứng. SO2 + H2SO4 đ không phản ứng.
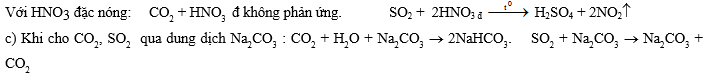
6. Hai bình kín A, B đều có dung tích không đổi 9,96 lít chứa không khí (21% oxi và 79% nitơ về thể tích) ở 27,30C và 752,4 mmHg. Cho vào cả 2 bình những lượng như nhau hỗn hợp ZnS và FeS2. Trong bình B còn thêm một ít bột lưu huỳnh (không dư). Sau khi nung bình để đốt cháy hết hỗn hợp sunfua và lưu huỳnh, đưa nhiệt độ bình về 136,50C, lúc đó trong bình A áp suất là pA và oxi chiếm 3,68% thể tích, trong bình B áp suất là pB và nitơ chiếm 83,16% thể tích.
1. Tính % thể tích các khí trong bình A.
2. Nếu lượng lưu huỳnh trong bình B thay đổi thì % thể tích các khí trong bình B thay đổi như thế nào ?
3. áp suất pA và pB.
4. Tính khối lượng hỗn hợp ZnS và FeS2 đã cho vào trong mỗi bình.Cho: O = 16, S = 32, Zn = 65, Fe = 56.
Giải
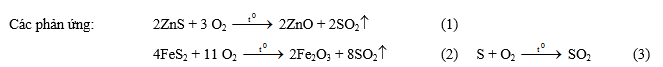
1. Theo (3) cứ 1mol O2 (k) mất đi lại sinh ra 1mol SO2 (k), nghĩa là tổng số mol khí trong hai bình như nhau, do đó %V của N2 trong 2 bình như nhau = 83,16% và % SO2 = 100% - 83,16% - 3,68% = 13,16%.
2. Do tổng số mol khí không đổi, nên % N2 luôn bằng 83,16%, còn tuỳ thuộc vào lượng S mà %O2 hoặc bằng trong bình A (nếu không có S) hoặc hết (nếu nhiều S), tức 0% ≤ %O2 ≤ 3,68%, còn % SO2 thì hoặc bằng trong bình A (nếu không có S) hoặc thêm SO2 do đốt S; tức là: 13,16% ≤ % SO2 ≤ 13,16 + 3,68 = 16,84%.
3. Thể tích và nhiệt độ như nhau, tổng số mol bằng nhau, nên PA = PB.
Gọi tổng số mol không khí ban đầu là n0, có:
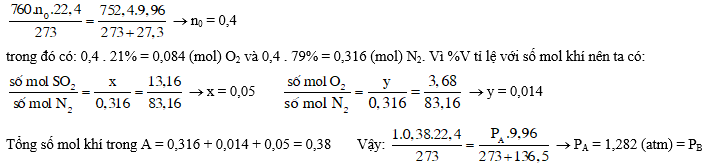
Số mol O2 tham gia phản ứng (1) và (2) = 0,084 – 0,014 = 0,07.
Gọi số mol ZnS và FeS2 lần lượt là: a và b, ta có:

Ý kiến bạn đọc
Bạn cần đăng nhập với tư cách là Thành viên chính thức để có thể bình luận
Những tin mới hơn
Những tin cũ hơn
global video
-
-
 Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
-
 Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
-
 Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Thăm dò ý kiến
Tin xem nhiều
-
 Bài tập về thấu kính hội tụ
Bài tập về thấu kính hội tụ
-
 DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
-
 ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
-
 ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
-
 Bài tập về thấu kính phân kỳ
Bài tập về thấu kính phân kỳ
-
 Dạng bài tập về Đoạn mạch nối tiếp
Dạng bài tập về Đoạn mạch nối tiếp
-
 Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
-
 Dạng bài tập đoạn mạch song song
Dạng bài tập đoạn mạch song song
-
 CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
-
 TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
Thống kê
- Đang truy cập80
- Hôm nay23,173
- Tháng hiện tại743,087
- Tổng lượt truy cập18,831,271
Tài liệu mới
- chuyên đề Phương trình... - 18/04/2022
- Phương trình chứa ấn ở... - 28/02/2020
- Các dạng bài tập phương... - 28/02/2020
- Giáo án dạy thêm toán 6 - 27/02/2020
- Chuyên đề bồi dưỡng học... - 27/02/2020
