THÍ NGHIỆM THỰC HÀNH HÓA HỌC
Bài tập 1. Nêu dụng cụ, hóa chất và cách tiến hành thí nghiệm điều chế etilen trong phòng thí nghiệm? Khí etilen sinh ra có thể lẫn những tạp chất gì ? Giải thích bằng phản ứng hóa học. Nêu cách loại bỏ các tạp chất đó ?

GIẢI
Hóa chất: Rượu etylic khan (hoặc cồn 96o), H2SO4 đặc, dung dịch NaOH, CuSO4 khan.
Dụng cụ: ống nghiệm có nhánh, ống dẫn khí, nút cao su có lỗ, đá bọt, đèn cồn, giá đỡ.
Cách tiến hành: Cho 2ml rượu etylic khan vào ống nghiệm khô, có sẵn vài viên đá bọt, sau đó thêm từng giọt H2SO4 đặc (4 ml) vào, đồng thời lắc đều. Đun nóng hỗn hợp phản ứng sao cho dung dịch không trào lên ống dẫn khí.
Bài tập 2. Khi tiến hành thí nghiệm: Phản ứng của nhôm với dung dịch CuSO4, hai học sinh tiến hành như sau:
HS1: Đánh sạch lá nhôm bằng giấy ráp rồi nhúng ngay vào dung dịch CuSO4 bão hòa.
HS2: Nhúng lá nhôm chưa đánh giấy ráp vào dung dịch CuSO4 bão hòa.
Hai học sinh trên quan sát được hiện tượng như thế nào, tại sao ?
GIẢI
TN1: Quan sát thấy có Cu màu đỏ bám vào đồng thời có khí thoát ra ngay từ đầu, màu xanh của dung dịch nhạt dần vì xảy ra các phản ứng sau:
2Al + 3CuSO4 ® Al2(SO4)3 + 3Cu
2Al + 3H2SO4 ® Al2(SO4)3 + 3H2
H2SO4 sinh ra do quá trình thủy phân của CuSO4.
TN2: Thời gian đầu chưa có hiện tượng gì, sau đó quan sát được hiện tượng như TN1
Do không cạo lớp màng oxit bao phủ bên ngoài miếng nhôm nên nhôm không tham gia các phản ứng với môi trường. Sau một thời gian, lớp oxit bị hòa tan bởi H2SO4 ( là sản phẩm của phản ứng thủy phân CuSO4):
Al2O3 + 3H2SO4 ® Al2(SO4)3 + 3H2O
Khi nhôm oxit tan hết, Al tác dụng với dung dịch CuSO4 và H2SO4 như trên.
Bài tập 3.
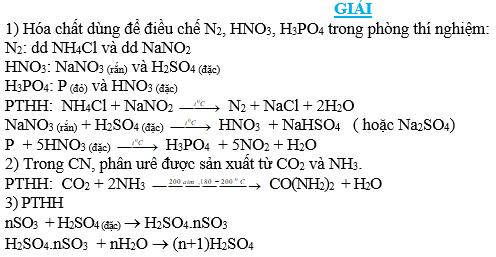
1) Trong phòng thí nghiệm người ta dùng hóa chất nào để điều chế các chất sau: N2, HNO3, H3PO4. Viết PTHH minh họa.
2) Trong công nghiệp, phân ure được sản xuất từ hóa chất nào? Viết PTHH xảy ra.
3) Trong thực tế sản xuất axit sunfuric, giai đoạn 3 của quá trình sản xuất axit sunfuric là cho SO3 vào một lượng H2SO4 đặc để tạo ra oleum rồi pha oleum vào nước thu được axit sunfuric. Viết PTHH để minh họa.
GIẢI
X: Cu; Y: H2SO4 đặc; Z; SO2
Vai trò của bình chứa dung dịch H2SO4 đặc: Làm khô khí.

Chỉ có thể dùng lượng dư dung dịch NaOH loãng để loại bỏ các tạp chất trên:
2NaOH + SO2 ® Na2SO3 + H2O
2NaOH + CO2 ® Na2CO3 + H2O
Không thể dùng dung dịch brom, dung dịch thuốc tím và dung dịch Na2CO3 để làm sạch khí vì etilen có phản ứng với dd brom, dung dịch thuốc tím và SO2 có phản ứng với Na2CO3 sinh ra tạp chất CO2:
CH2=CH2 + Br2 ® Br-CH2-CH2-Br
3C2H4 + 2KMnO4 + 4H2O ® 3C2H4(OH)2 + 2MnO2 + 2KOH
SO2 + Na2SO3 ® Na2SO3 + CO2
Bài tập 5. Có 2 bình X, Y mắc nối tiếp. Dẫn hỗn hợp khí gồm etilen và sunfurơ qua bình X chứa lượng dư dung dịch brom trong CCl4 và bình Y chứa lượng dư dung dịch thuốc tím thì quan sát thấy điều gì? Nếu đổi hóa chất trong 2 bình cho nhau thì hiện tượng quan sát được sẽ như thế nào? Giải thích?
GIẢI
Dẫn 2 khí qua bình X ( chứa brom dư trong CCl4), rồi đến bình Y ( chứa thuốc tím dư)
Bình X: Dung dịch brom bị nhạt màu vì xảy ra phản ứng sau.
CH2=CH2 + Br2 ® Br-CH2-CH2-Br
Bình Y: Dung dịch thuốc tím bị nhạt màu vì SO2 không phản ứng với Br2 trong dung môi CCl4 nên di chuyển sang bình Y và phản ứng với thuốc tím theo phản ứng sau:
5SO2 + 2KMnO4 + 2H2O ® K2SO4 + 2MnSO4 + 2H2SO4
Dẫn 2 khí qua bình X ( chứa thuốc tím dư), rồi đến bình Y ( chứa brom dư trong CCl4)
Bình X: Dung dịch thuốc tím bị nhạt màu nhiều hơn ở trường hợp trên vì xảy ra đồng thời 2 phản ứng sau:
3CH2=CH2 + 2KMnO4 + 4H2O ® 3HO-CH2-CH2-OH + 2KOH + 2MnO2
5SO2 + 2KMnO4 + 2H2O ® K2SO4 + 2MnSO4 + 2H2SO4
Bình Y: màu của dung dịch brom không đổi vì thuốc tím ở bình X dư nên SO2 và C2H4 hết ® Không có phản ứng xảy ra giữa C2H4 với Br2 trong bình Y.
Bài tập 6. Lấy một sợi dây điện gọt bỏ vỏ nhựa bằng PVC rồi đốt lõi đồng trên ngọn lửa đèn cồn thì thấy ngọn lửa có màu xanh lá mạ. Sau một lúc, ngọn lửa mất màu xanh. Nếu áp lõi dây đồng đang nóng vào vỏ nhựa ở trên rồi đốt thì ngọn lửa lại có màu xanh lá mạ. Giải thích?
GIẢI
Khi gọt bỏ vỏ nhựa (PVC), lõi đồng ít nhiều vẫn còn PVC nên khi đốt sẽ có quá trình sinh ra CuCl2, CuCl2 phân tán vào ngọn lửa, ion đồng (II) tạo màu xanh lá mạ đặc trưng. Khi hết hết PVC, ngọn lửa lại không màu. Nếu cho dây đồng áp vào PVC thì hiện tượng lặp lại.
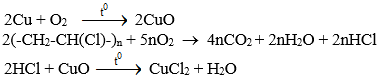
Bài tập 7. Trong phòng thí nghiệm chỉ có H2SO4 đặc, nước cất, phôi bào sắt. Dụng cụ thí nghiệm có đủ. Trình bày cách tiến hành thí nghiệm, cho biết hiện tượng quan sát được và giải thích khi cho Fe vào lượng dư các dung dịch sau: H2SO4 loãng; H2SO4 đặc nguội; H2SO4 đặc, đun nóng.
Bước 1: Pha chế dung dịch H2SO4 loãng: Cho từ từ từng giọt H2SO4 vào nước và khuấy đều ta thu được dung dịch H2SO4 loãng. Tuyệt đối không làm ngược lại.
Bước 2: Tiến hành thí nghiệm:
TN1: Cho phôi bào Fe vào ống nghiệm chứa khoảng 2 ml dung dịch H2SO4 loãng:
HT: Thấy Fe tan dần, có khí không màu, không mùi thoát ra.
GT: Vì xảy ra phản ứng sau.
Fe + H2SO4 (loãng) ® FeSO4 + H2
TN2: Cho phôi bào Fe vào ống nghiệm chứa khoảng 2 ml dung dịch H2SO4 đặc, nguội.
HT: Không có hiện tượng gì xảy ra.
GT: Do Fe thụ động với H2SO4 đặc nguội.
TN3: Cho phôi bào Fe vào ống nghiệm chứa khoảng 2 ml dung dịch H2SO4 đặc rồi đun nóng trên ngọn lửa đèn cồn.
HT: Fe tan dần, tạo dung dịch màu vàng nâu và có khí không màu, mùi hắc thoát ra.
GT: Vì H2SO4 đặc nóng có tính oxi hóa mạnh, oxi hóa Fe thành muối sắt (III) có màu vàng nâu đồng thời S trong H2SO4 bị khử thành SO2 là chất khí không màu, mùi hắc.
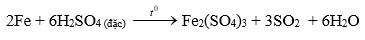
Hóa chất: Rượu etylic khan (hoặc cồn 96o), H2SO4 đặc, dung dịch NaOH, CuSO4 khan.
Dụng cụ: ống nghiệm có nhánh, ống dẫn khí, nút cao su có lỗ, đá bọt, đèn cồn, giá đỡ.
Cách tiến hành: Cho 2ml rượu etylic khan vào ống nghiệm khô, có sẵn vài viên đá bọt, sau đó thêm từng giọt H2SO4 đặc (4 ml) vào, đồng thời lắc đều. Đun nóng hỗn hợp phản ứng sao cho dung dịch không trào lên ống dẫn khí.

Bài tập 2. Khi tiến hành thí nghiệm: Phản ứng của nhôm với dung dịch CuSO4, hai học sinh tiến hành như sau:
HS1: Đánh sạch lá nhôm bằng giấy ráp rồi nhúng ngay vào dung dịch CuSO4 bão hòa.
HS2: Nhúng lá nhôm chưa đánh giấy ráp vào dung dịch CuSO4 bão hòa.
Hai học sinh trên quan sát được hiện tượng như thế nào, tại sao ?
GIẢI
TN1: Quan sát thấy có Cu màu đỏ bám vào đồng thời có khí thoát ra ngay từ đầu, màu xanh của dung dịch nhạt dần vì xảy ra các phản ứng sau:
2Al + 3CuSO4 ® Al2(SO4)3 + 3Cu
2Al + 3H2SO4 ® Al2(SO4)3 + 3H2
H2SO4 sinh ra do quá trình thủy phân của CuSO4.
TN2: Thời gian đầu chưa có hiện tượng gì, sau đó quan sát được hiện tượng như TN1
Do không cạo lớp màng oxit bao phủ bên ngoài miếng nhôm nên nhôm không tham gia các phản ứng với môi trường. Sau một thời gian, lớp oxit bị hòa tan bởi H2SO4 ( là sản phẩm của phản ứng thủy phân CuSO4):
Al2O3 + 3H2SO4 ® Al2(SO4)3 + 3H2O
Khi nhôm oxit tan hết, Al tác dụng với dung dịch CuSO4 và H2SO4 như trên.
Bài tập 3.
1) Trong phòng thí nghiệm người ta dùng hóa chất nào để điều chế các chất sau: N2, HNO3, H3PO4. Viết PTHH minh họa.
2) Trong công nghiệp, phân ure được sản xuất từ hóa chất nào? Viết PTHH xảy ra.
3) Trong thực tế sản xuất axit sunfuric, giai đoạn 3 của quá trình sản xuất axit sunfuric là cho SO3 vào một lượng H2SO4 đặc để tạo ra oleum rồi pha oleum vào nước thu được axit sunfuric. Viết PTHH để minh họa.

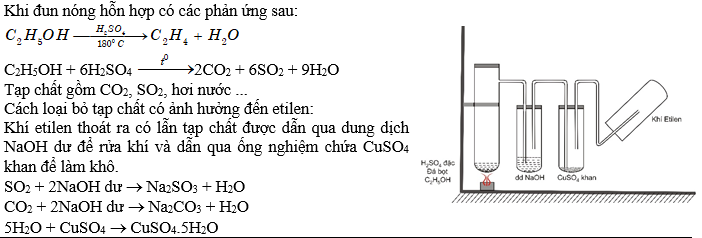
| Bài tập 4. 1) Hình vẽ sau đây dùng để điều chế chất khí nào trong phòng thí nghiệm. Cho biết X, Y, Z. Nêu vai trò của bình chứa dung dịch Y và bông tẩm dung dịch thuốc tím. Viết PTHH. 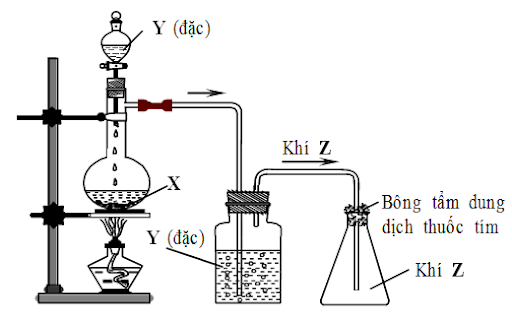 2) Khí etilen được điều chế từ rượu etylic và H2SO4 đặc đun nóng ở nhiệt độ trên 1700C thường có lẫn tạp chất nào? Có thể dùng lượng dư hóa chất nào sau đây để làm sạch etilen: dung dịch brom, dung dịch thuốc tím, dung dịch Na2CO3, dung dịch NaOH? Viết PTHH để giải thích? |
X: Cu; Y: H2SO4 đặc; Z; SO2
Vai trò của bình chứa dung dịch H2SO4 đặc: Làm khô khí.

Chỉ có thể dùng lượng dư dung dịch NaOH loãng để loại bỏ các tạp chất trên:
2NaOH + SO2 ® Na2SO3 + H2O
2NaOH + CO2 ® Na2CO3 + H2O
Không thể dùng dung dịch brom, dung dịch thuốc tím và dung dịch Na2CO3 để làm sạch khí vì etilen có phản ứng với dd brom, dung dịch thuốc tím và SO2 có phản ứng với Na2CO3 sinh ra tạp chất CO2:
CH2=CH2 + Br2 ® Br-CH2-CH2-Br
3C2H4 + 2KMnO4 + 4H2O ® 3C2H4(OH)2 + 2MnO2 + 2KOH
SO2 + Na2SO3 ® Na2SO3 + CO2
Bài tập 5. Có 2 bình X, Y mắc nối tiếp. Dẫn hỗn hợp khí gồm etilen và sunfurơ qua bình X chứa lượng dư dung dịch brom trong CCl4 và bình Y chứa lượng dư dung dịch thuốc tím thì quan sát thấy điều gì? Nếu đổi hóa chất trong 2 bình cho nhau thì hiện tượng quan sát được sẽ như thế nào? Giải thích?
GIẢI
Dẫn 2 khí qua bình X ( chứa brom dư trong CCl4), rồi đến bình Y ( chứa thuốc tím dư)
Bình X: Dung dịch brom bị nhạt màu vì xảy ra phản ứng sau.
CH2=CH2 + Br2 ® Br-CH2-CH2-Br
Bình Y: Dung dịch thuốc tím bị nhạt màu vì SO2 không phản ứng với Br2 trong dung môi CCl4 nên di chuyển sang bình Y và phản ứng với thuốc tím theo phản ứng sau:
5SO2 + 2KMnO4 + 2H2O ® K2SO4 + 2MnSO4 + 2H2SO4
Dẫn 2 khí qua bình X ( chứa thuốc tím dư), rồi đến bình Y ( chứa brom dư trong CCl4)
Bình X: Dung dịch thuốc tím bị nhạt màu nhiều hơn ở trường hợp trên vì xảy ra đồng thời 2 phản ứng sau:
3CH2=CH2 + 2KMnO4 + 4H2O ® 3HO-CH2-CH2-OH + 2KOH + 2MnO2
5SO2 + 2KMnO4 + 2H2O ® K2SO4 + 2MnSO4 + 2H2SO4
Bình Y: màu của dung dịch brom không đổi vì thuốc tím ở bình X dư nên SO2 và C2H4 hết ® Không có phản ứng xảy ra giữa C2H4 với Br2 trong bình Y.
Bài tập 6. Lấy một sợi dây điện gọt bỏ vỏ nhựa bằng PVC rồi đốt lõi đồng trên ngọn lửa đèn cồn thì thấy ngọn lửa có màu xanh lá mạ. Sau một lúc, ngọn lửa mất màu xanh. Nếu áp lõi dây đồng đang nóng vào vỏ nhựa ở trên rồi đốt thì ngọn lửa lại có màu xanh lá mạ. Giải thích?
GIẢI
Khi gọt bỏ vỏ nhựa (PVC), lõi đồng ít nhiều vẫn còn PVC nên khi đốt sẽ có quá trình sinh ra CuCl2, CuCl2 phân tán vào ngọn lửa, ion đồng (II) tạo màu xanh lá mạ đặc trưng. Khi hết hết PVC, ngọn lửa lại không màu. Nếu cho dây đồng áp vào PVC thì hiện tượng lặp lại.
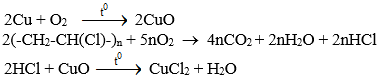
Bài tập 7. Trong phòng thí nghiệm chỉ có H2SO4 đặc, nước cất, phôi bào sắt. Dụng cụ thí nghiệm có đủ. Trình bày cách tiến hành thí nghiệm, cho biết hiện tượng quan sát được và giải thích khi cho Fe vào lượng dư các dung dịch sau: H2SO4 loãng; H2SO4 đặc nguội; H2SO4 đặc, đun nóng.
Bước 1: Pha chế dung dịch H2SO4 loãng: Cho từ từ từng giọt H2SO4 vào nước và khuấy đều ta thu được dung dịch H2SO4 loãng. Tuyệt đối không làm ngược lại.
Bước 2: Tiến hành thí nghiệm:
TN1: Cho phôi bào Fe vào ống nghiệm chứa khoảng 2 ml dung dịch H2SO4 loãng:
HT: Thấy Fe tan dần, có khí không màu, không mùi thoát ra.
GT: Vì xảy ra phản ứng sau.
Fe + H2SO4 (loãng) ® FeSO4 + H2
TN2: Cho phôi bào Fe vào ống nghiệm chứa khoảng 2 ml dung dịch H2SO4 đặc, nguội.
HT: Không có hiện tượng gì xảy ra.
GT: Do Fe thụ động với H2SO4 đặc nguội.
TN3: Cho phôi bào Fe vào ống nghiệm chứa khoảng 2 ml dung dịch H2SO4 đặc rồi đun nóng trên ngọn lửa đèn cồn.
HT: Fe tan dần, tạo dung dịch màu vàng nâu và có khí không màu, mùi hắc thoát ra.
GT: Vì H2SO4 đặc nóng có tính oxi hóa mạnh, oxi hóa Fe thành muối sắt (III) có màu vàng nâu đồng thời S trong H2SO4 bị khử thành SO2 là chất khí không màu, mùi hắc.
Ý kiến bạn đọc
Bạn cần đăng nhập với tư cách là Thành viên chính thức để có thể bình luận
Những tin mới hơn
Những tin cũ hơn
global video
-
-
 Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
Hướng dẫn giải bài tập về vận...
hướng dẫn ôn tập và giải các bài tập về
-
 Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
Hướng dẫn giải bài tập về công...
hướng dẫn ôn tập và giải các bài tập về công cơ học
-
 Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Hướng dẫn giải bài tập về lực...
Hướng dẫn giải bài tập về
Thăm dò ý kiến
Tin xem nhiều
-
 Bài tập về thấu kính hội tụ
Bài tập về thấu kính hội tụ
-
 DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
DẠNG TOÁN HỖN HỢP TRONG HÓA HỌC
-
 ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
ĐỀ THI CHỌN ĐỘI TUYỂN HỌC SINH GIỎI LỚP 9 MÔN GDCD
-
 ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
ĐỀ THI CHỌN HỌC SINH GIỎI LỚP 9 MÔN NGỮ VĂN
-
 Bài tập về thấu kính phân kỳ
Bài tập về thấu kính phân kỳ
-
 Dạng bài tập về Đoạn mạch nối tiếp
Dạng bài tập về Đoạn mạch nối tiếp
-
 Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
Cách mạng tháng tám 1945: Thời cơ, diễn biến, ý nghĩa lịch sử và bài học kinh nghiệm của cách mạng tháng tám 1945
-
 Dạng bài tập đoạn mạch song song
Dạng bài tập đoạn mạch song song
-
 CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
CUỘC CÁCH MẠNG KHOA HỌC KĨ THUẬT LẦN THỨ HAI
-
 TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
TRỢ TỪ – THÁN TỪ – TÌNH THÁI TỪ
Thống kê
- Đang truy cập90
- Hôm nay19,919
- Tháng hiện tại614,421
- Tổng lượt truy cập18,702,605
Tài liệu mới
- chuyên đề Phương trình... - 18/04/2022
- Phương trình chứa ấn ở... - 28/02/2020
- Các dạng bài tập phương... - 28/02/2020
- Giáo án dạy thêm toán 6 - 27/02/2020
- Chuyên đề bồi dưỡng học... - 27/02/2020
